美国加州Miramal海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2 2H2O,负极反应为:H2+CO32-→H2O+CO2+2e-。
则下列推断中,正确的是
| A.正极反应为4OH—→2H2O+O2+4e-↑ |
| B.当电池生成1mol水时,转移4mol电子 |
| C.放电时CO32-向负极移动 |
| D.放电时电子向负极移动 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均减小 |
| D.产生气泡的速度甲比乙快 |
某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,该金属可能为
| A.铝 | B.铜 | C.锡 | D.硅 |
可逆反应:2NO2(g)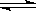 2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmol O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变⑤混合气体的密度不再改变
| A.①④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
已知空气-锌电池的电极反应为:
锌片:Zn+2OH--2e-=ZnO+H2O
石墨:O2+2H2O +4e-=4OH-
根据此判断,锌片是:
| A.负极,并被氧化 | B.负极,并被还原 |
| C.正极,并被氧化 | D.正极,并被还原 |
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,正反应和逆反应的速率都为零 |