下表中有九种物质,据表回答: (12分)
| |
第I 组 |
第II 组 |
第III 组 |
| 甲 |
BaCl2 |
Fe |
Cu(NO3)2 |
| 乙 |
Fe2O3 |
K2SO4 |
H2SO4 |
| 丙 |
Zn |
Ba(OH)2 |
MgCl2 |
(1) 第III 组中有一种物质能与第 组中的所有物质反应,这种物质是 .
(2) 不跟第I 组中所有物质反应且能与第III 组中所有物质反应的第II 组中的物质是 ,其与硫酸反应的离子方程式为 ;
(1)宇宙飞船上的氢氧燃料电池,其电池反应为:2H2+O2=2H2O,试写出电解质溶液若为盐酸时的正极反应式:______________。
(2)已知4 g甲烷气体充分燃烧生成CO2(g)和H2O(l)时,放出Q kJ的热量。写出表示甲烷燃烧热的热化学方程式:______________________。
(3)已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-Q1 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-Q2 kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=-Q3 kJ/mol
利用盖斯定律计算:FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变ΔH=________。
某研究小组设计如下工艺路线提纯工业碳酸钠。已知工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42—等杂质。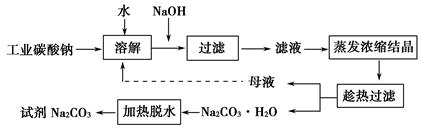
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示: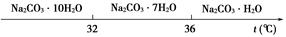
Ⅱ.有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe(OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
根据所给信息,回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为___________________________。
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=__________________________________________
(2)“趁热过滤”时的温度应控制在____________________________________
(3)有人从“绿色化学”的角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行__________________,并说明理由_______________________________________
海南省是海洋大省,海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。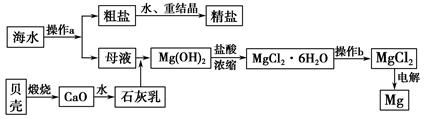
回答下列问题:
(1)流程图中操作a的名称为_________________________________________。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①则气体A应是_______________(填化学式),其过程反应方程式为_______________________________。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是_______________________________________________。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。操作b是在__________气氛中进行,若在空气中加热,则会水解生成Mg(OH)Cl,写出有关反应的化学方程式_________________________________________。
(4)一氯碱厂每天消耗234吨NaCl,这些NaCl能生产质量分数为32%的烧碱溶液__________吨,同时转移__________mol电子。
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。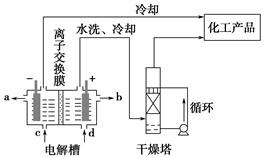
(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为___________________________________。
②SiCl4可转化为SiHCl3而循环使用,一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气________m3(标准状况)。
我们的生活、学习离不开物质,其中很多物质是通过工业生产而得到的。请回答下列问题:
(1)生活用水是来自于自来水公司的管道水,其来源有两个:地表水和地下水。地表水中往往含有悬浮物和胶体,自来水厂需要对地表水进行________处理;地下水中往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行__________处理。
(2)有限的土地,要提高粮食产量,离不开科学技术,离不开化学肥料的合理使用。铵态氮肥中的“铵”的生产原料为________,该物质在工业生产中使用的条件是__________________________________。
(3)患有近视的同学学习离不开眼镜,眼镜片有玻璃和合成树脂的。其中易碎的镜片材料是__________,镜片有灰尘不能用酒精擦拭的是__________。
(4)厨房中离不开食盐,该物质主要来自于海水,写出一种用海水制备食盐的方法____________,工业上可用食盐制备纯碱,食盐的作用是________________________。