某同学用10mol• L-1的浓盐酸配制250mL 1mol• L-1的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸 mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
、 等。
(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为 g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为 。
下表为元素周期表的一部分,参照元素①~⑫在表中的位置,请回答下列问题。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 一 |
① |
|||||||
| 二 |
② |
③ |
④ |
⑤ |
||||
| 三 |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
⑪ |
⑫ |
(1)画出⑦的离子结构示意图____________________。
(2)⑤、⑥、⑪的原子中半径最大的是______________(写编号)。
(3)⑥和⑧的最高价的氧化物的水化物中碱性弱些的是________。(填化学式)
(4)④、⑩的气态氢化物中的稳定性强些的是_______。(填化学式)
(5)写出②和⑫组成的各原子最外层电子都满足8电子的物质的化学式_____________。
(6)写出一种由①④组成且含有非极性键的物质的电子式_____________。
(7)③的最高价含氧酸的稀溶液与铜粉反应的离子方程式_______________________。
(8)利用较强酸能制出较弱酸的原理,写出一个能证明②和⑨非金属性强弱的一个常见反应的化学方程式_______________。
水解反应是中学化学中的一大类反应。
(1)在 ①酸 ②碱 ③盐 ④不饱和烃 ⑤卤代烃 ⑥醇 ⑦醛 ⑧酯 ⑨低聚糖 ⑩蛋白质等物质中,能发生水解的物质有(填编号)。蔗糖水解的产物名称为。
(2)写出二甲基二氯硅烷[(CH3)2SiCl2 ]水解得到二甲基硅二醇的化学方程式:。
(3)溴乙烷水解实验的操作为:取一支试管,加入0.5 mL溴乙烷,再加入2 mL 5% 的NaOH溶液,充分振荡后静置,待液体分层后,用滴管小心吸取10滴上层水溶液,转入另一盛有10 mL稀HNO3溶液的试管中,然后加入3滴2 % 的AgNO3溶液,观察反应现象。
请根据上述操作回答以下问题:
①本实验中涉及溴乙烷的物理性质主要有,稀HNO3的作用是。
②甲同学在盛溴乙烷和NaOH溶液的试管口塞紧带长玻璃管的单孔橡皮塞,然后水浴加热数分钟,最后液体不再分层。反应的化学方程式为。
③乙同学认为:要证明上述实验中溴乙烷发生了水解反应,需要先做一个对比实验证明溴乙烷自身不能电离出溴离子,此实验操作步骤和现象是。
A、B、C、D、E五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料,它们的结构简式如下:
请回答下列问题:
(1)A的分子式为;这五种化合物中,互为同分异构体的是(填序号)。
(2)若 ,且Y是D的同分异构体,写出反应①的化学方程式:,Y的结构简式为,反应③属于反应。
,且Y是D的同分异构体,写出反应①的化学方程式:,Y的结构简式为,反应③属于反应。
某化学兴趣小组设计了下图所示实验装置,其中c为石墨电极,d为银电极。
(1)甲池中OH-移向极(填电极的字母序号),f为(填电极名称)。
(2)a极上的电极反应式是。
(3)乙池中放出气体的电极为极(填“c”或“d”),写出此电极反应式:。
(4)乙池中总反应的离子方程式是。
(5)当乙池中阴极质量增加5.40 g时,丙池某电极析出1.60 g金属,则丙池的溶液中溶质可能是(填序号)。
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液。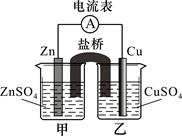
(1)Cu极为原电池的极(填“正”或“负”),电极反应式是;Zn极发生(填“氧化”或“还原”)反应。
(2)盐桥中K+移向(填“甲”或“乙”)烧杯的溶液。取出盐桥,电流计指针(填“偏转”或“不偏转”)。
(3)若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,则两烧杯中的电极反应式分别为:甲,乙。