如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+ Y(?) a Z(g)
a Z(g)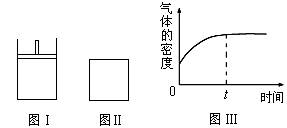
此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
| A.物质Z的化学计量数a = 2 |
| B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
| A.x=1 |
| B.2 min内A的反应速率 为0.3 mol·(L·min)-1 |
| C.B的转化率为40% |
| D.若混合气体的密度不变,则表明该反应已达到平衡状态 |
下列有关反应限度的叙述正确的是( )
| A.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 |
| B.依据焓判据:NH4HCO3受热分解可自发进行 |
| C.大多数化学反应在一定条件下都有一定的限度 |
| D.FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深 |
参照反应Br+H2―→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
| A.正反应为吸热反应 |
| B.正反应为放热反应 |
| C.加入催化剂,该化学反应的反应热增大 |
| D.从图中可看出,该反应的反应热与反应途径有关 |
下列关于能量变化的说法正确的是( )
| A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 |
| B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种 |
| C.已知C(石墨,s)===C(金刚石, s) ΔH>0,则金刚石比石墨稳定 |
| D.化学反应遵循质量守恒的同时,也遵循能量守恒 |
下列说法中正确的是( )
| A.任何化学反应都伴随着能量的变化 |
| B.1 mol H2SO4和1 mol Ba(OH)2完全反应所放出的热量称为中和热 |
| C.在101 kPa时,1 mol碳燃烧放出的热量就是碳的燃烧热 |
| D.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据 |