U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
⑴V的单质分子的结构式为_______________;XW的电子式为____________;
Z元素在周期表中的位置是 。
⑵U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明:_______________________________。
⑷YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为:__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
(13分) 如图所示,各物质间有下列转化关系: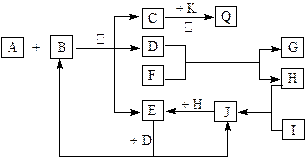
A、F分别为淡黄色固体,A与B的浓溶液反应可以生成C、D、E三种物质,D为无色液体,K为红色金属单质,能在加热条件下与C的浓溶液反应,生成气体Q。I和H为气态双原子分子。反应过程中部分条件和产物均略去。
(1)I的电子式:____________________。
(2)反应A + B的化学方程式:_________________________________________________。
(3)将Q和E按2∶1同时通入品红溶液中,若产物之一含I,则现象可能为___________,原理是(用化学方程式表示)______________________________________________。
(4)若标准状况下将11.2 L Q通入到500 mL 1.5 mol /L 的G溶液中,请将最终溶液的溶质成分及物质的量填入下表(可不填满)。
| 溶质(化学式) |
物质的量 |
(9分) A、B、C、D是中学化学中常见的四种短周期元素。已知①A具有多种同素异形体,A元素原子最外层电子数是次外层电子数的2倍。②B元素最高正价为 + 5。③C元素有多种化合价,且常温下C元素的单质与某种一元碱溶液反应,可得到两种含C元素的化合物。④B、C两种元素质子数之和是A元素质子数的4倍。⑤D是地壳中含量第二的元素,它的单质是一种良好的半导体材料。
(1)写出A元素的名称_________和C离子的结构示意图____________。
(2)工业上利用A的单质来制备单质D,请写出相应的方程式:
________________________________________________________________________。
(3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种见的漂白性物质和一种能使石蕊试纸变蓝的气体。则X的分子式。X分子中B、C原子间的化学键的类型为___________(填“极性键”或“非极性键”)。X与水反应的化学方程式________________________。
(12分) 如下图所示,在一个烧瓶中充满气体A,打开①处的止水夹向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。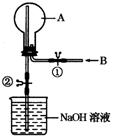
(1)请按要求填表回答打开②处的止水夹前烧瓶中所观察到的现象并按要求书写反应的化学方程式: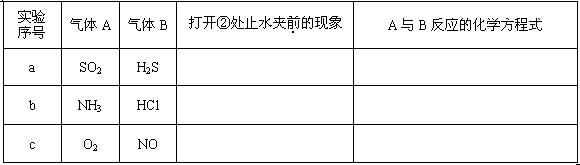
(2) 打开②处的止水夹后,烧瓶内剩余气体最多的是(填实验序号)____________。
(10分) 硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)V2O5是SO2与O2反应的催化剂,请写出该反应的方程式:
_____________________________________________________________________。
(2)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为_____________;生成SO3的化学反应速率为_________________。
(3)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
| A.压缩体积,增大压强 | B.降低温度 |
| C.充入大量的氮气 | D.仅增加SO2的浓度 |
(4)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式
______________________________________________________。
(10分) 按要求填空
(1)配平下列化学方程式:
______P + ________FeO + _______CaO =_______Ca3(PO4)2 +_________Fe
(2)制造光导纤维的材料是_________;三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(3)除去NaHCO3溶液中少量的Na2CO3杂质相应的离子方程式为__________________________________________。
(4)检验SO42-所需要用的试剂__________________和__________________。