黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O =SO42-+ 2Fe2++ 4H+
Cr2O72-+ 6 Fe2+ + 14 H+="2" Cr3+ + 6 Fe3+ + 7 H2O
⑴①黄铁矿煅烧的化学方程式为: 。
②样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式: ________________ ___________________________。
___________________________。
⑶煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_____________L,制得98%的 硫酸质量为_________ t ,SO2全部转化为H2SO4时放出的热量是 kJ。
硫酸质量为_________ t ,SO2全部转化为H2SO4时放出的热量是 kJ。
(4)硫酸的用途非常广泛,请写出用之制取“普钙”的化学方程式并用最简洁的语言解释为什么这种化肥不能与草木灰混合施用: ;
、 。
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:
CO(g)+2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________
| A.体系压强保持不变 |
| B.混合气体的密度保持不变 |
| C.CO与H2的浓度之比为1∶2 |
| D.单位时间内,消耗2molH2的同时消耗1mol CH3OH |
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是 ;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K(写出计算过程)。
(2)已知: CO(g)+  O2(g)=CO2(g)△H2=-283 kJ·mol-1H2(g)+
O2(g)=CO2(g)△H2=-283 kJ·mol-1H2(g)+  O2(g)=H2O(g)△H3=-242 kJ·mol-1
O2(g)=H2O(g)△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气的热化学方程式为 __________
在体积为2 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g) △H=Q,化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g) △H=Q,化学平衡常数K与温度T的关系如下表:
| T/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)Q____0(填 “>”、“<”),升高温度,化学平衡向________(填“正反应”或“逆反应”)方向移动。
(2)若某温度下,平衡浓度符合下列关系:c(CO2)·c(H2)=c(CO)·c(H2O),此时的温度为__________;在此温度下,若该容器中含有1mol CO2、3mol H2、2mol CO、2mol H2O,则此时反应所处的状态为____________(填“向正反应方向进行中”、“向逆反应方向进行中”或“平衡状态”),此温度平衡时CO2的浓度为___________ mol·L-1;在此温度下,若该容器中含有1.5mol CO2、3.5mol H2、1.5mol CO、1.5mol H2O达到平衡时CO2的浓度为___________ mol·L-1。
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l)ΔH=-2220.0 kJ·mol-1
H2O(l)=H2O(g)ΔH="+44.0" kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为___________。
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2=2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将_________能转化为___________能。其电极反应式分别为:
负极_________________________,正极_____________________________。
某温度时,在一个容积为2 L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: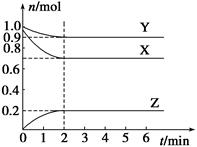
(1)该反应的化学方程式为_______________;
(2)反应开始至2 min,气体Z的反应速率为____________;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的________倍;
②若此时将容器的体积缩小为原来的 0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
按下图所示装置进行实验,并回答下列问题: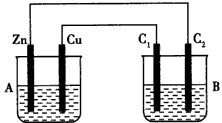

(1)判断装置的名称:A池为__________________,B池为________________________。
(2)铁极为_________极,电极反应式为________________________;铜极为________极,电极反应式为________________________ ;石墨棒C1为_______极,电极反应式为____________________________;石墨棒C2附近发生的实验现象为________,反应结束后,B池溶液的pH值________。(增大、减小、不变,忽略气体溶于水)
(3)当C2极析出224 mL气体(标准状况下),铁的质量________(增加或减少)__________g