A、B、C、D四种可溶性盐,它们的阳离子可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子可能是NO3-、SO42-、Cl-、CO32-的某一种。
①若把四种盐分别溶解于盛有蒸馏水的四只试管中,只有C盐的溶液呈蓝色;
②若向⑴的四只试管中分别加盐酸,B溶液有沉淀产生,D溶液有无色无味气体逸出。
根据⑴⑵实验事实可推断它们的化学式为:
⑴A、 ;B、 ;C、 ;D、 ;
⑵写出D与盐酸反应的离子方程式: ;
一种烃的碳架呈三棱柱体(如图所示)
(1)写出该烃的分子式___ _______。
_______。
(2)该烃的一氯取代物有__________种。
(3)该烃的二氯取代物有__________种。
(4)该烃的同分异构体有多种,其中1种不能使酸性高锰酸钾溶液或Br2-CCl4溶液褪色,但在一定条件下能跟溴(或H2)发生取代(或加成)反应,这种同分异构体的结构简式是
____________________。
写出下列反应的化学方程式,注明反应类型:
(1)苯与浓硝酸、浓硫酸的混合物反应(60℃):___________________________________;
(2)甲苯制备 三硝基甲苯:_____________________________________________________;
三硝基甲苯:_____________________________________________________;
(3)乙烯与苯反应:__________________ ______________________________________;
______________________________________;
(4)丙烯与水反应生成醇(主要反应):__________________________________________;
反应类型依次是:____________________________________________________________。
(每空2分,共8分。)
1,4-环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
(1)写出反应④、⑦的化学方程式:
④______________________________________________________________;
⑦______________________________________________________________。
(2)上述七个反应中属于取代反应的有____________(填反应序号)。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为。
(每空2分,共10分。)
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。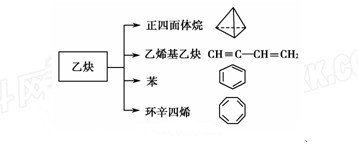
完成下列各题:
(1) 正四面体烷的二氯取代产物有________种。
正四面体烷的二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误 的是________。
的是________。
a.能使酸性KMnO4溶液褪色
b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举一例)________________。
(4)写出与环辛四烯互为同分异构体且属于芳香烃的物质发生加聚反应的反应方程式_______________。
(5)乙烯基乙炔可与HCl反应生成2-氯-1,3-丁二烯,写出2-氯-1,3-丁二烯加聚反应的反应方程式_______________。
(每空1分,共13分。)
(1)选择下列某种答案的序号,填入下表的空格。
①同位素②同素异形体③同分异构体④同系物⑤同种物质
| 物质 |
红磷 |
氯仿与 |
氕与 |
新戊烷与 |
2-甲基戊烷与 |
| 名称 |
与白磷 |
三氯甲烷 |
氘、氚 |
2,2-二甲基丁烷 |
2,3-二甲基丁烷 |
| 相互关系 |
(2)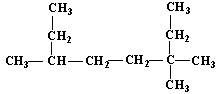 的名称为___________________________;
的名称为___________________________;
( 3)
3) 的名称为____________________________;
的名称为____________________________;
(4)2,4-二氯甲苯的结构简式为___________________________;
(5)反-2-戊烯的结 构简式为________________________________;
构简式为________________________________;
(6)某物质结构如图所示,其官能团是,;分子式为;
该物质可以与下列(填序号)发生反应。
A.酸性KMnO4溶液 B.氢气 C.溴水 D.NaOH溶液
B.氢气 C.溴水 D.NaOH溶液