(每空2分,共10分。)
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。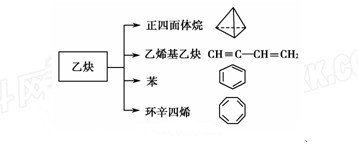
完成下列各题:
(1) 正四面体烷的二氯取代产物有________种。
正四面体烷的二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误 的是________。
的是________。
a.能使酸性KMnO4溶液褪色
b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举一例)________________。
(4)写出与环辛四烯互为同分异构体且属于芳香烃的物质发生加聚反应的反应方程式_______________。
(5)乙烯基乙炔可与HCl反应生成2-氯-1,3-丁二烯,写出2-氯-1,3-丁二烯加聚反应的反应方程式_______________。
(13分)A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应.B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100 mL2 mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素C位于第周期族,它的最高价氧化物的化学式为。
(2)写出元素的名称: A、B、D;
(3)A与D形成淡黄色的化合物的化学式为,
判断该化合物在空气中是否变质的简单方法是__。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为。
(11分)A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等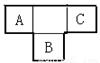
(1)写出元素的符号: A、B、C;
(2)B元素位于元素周期表中第 周期,第族。
(3)C的原子结构示意图为 ,用电子式表示C的单质与H2反应的过程。
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有 。
(12分)(1)下列变化(填序号)①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解。
未发生化学键破坏的是;仅发生离子键破坏的是;
仅发生共价键破坏的是;既发生离子键又发生共价键破坏的是;
(2)用电子式写出MgCl2、HCl的形成过程
①MgCl2的形成过程:;
②HCl的形成过程:;
(8分)由以下一些微粒:136C、3919K、4020Ca、126C、147N、4018Ar
其中:(1)互为同位素的是________和________;
(2)质量数相等,但不能互称同位素的是_________和__________;
(3)中子数相等,但质子数不相等的是和、和。
(8分)原子序数11-17的元素,自Na到Cl,电子层数相同,
(1)最外层电子数从增加到,随着核电荷数依次递增;
(2)原子半径依次(填“增大”或“减小”),核对外层电子的引力逐渐(填“增强”或“减弱”,下同);
(3)失电子能力逐渐,得电子能力逐渐,因此,金属性逐渐,非金属性逐渐。