利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。
Ⅰ.染料工业排放的废水中含有大量有毒的NO2¯,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为 。
Ⅱ.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
| 开始沉淀时的pH |
1.9 |
7.0 |
—— |
—— |
4.7 |
—— |
| 沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9 (>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。
(2)加入H2O2的作用是 。
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
(选填:Fe3+、Al3+、Ca2+、Mg2+)。
Ⅲ.印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤① ② ③过滤。(提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu)
Ⅰ、可逆反应:aA(g) + bB(g) cC(g) + dD(g);根据图回答:
cC(g) + dD(g);根据图回答:
①压强 P1 P2;(a +b) (c +d)(填“>”或“<”下同)。
②温度t1℃ t2℃;△H 0。
③保持体积和温度不变,通入He,平衡会_________________移动(填“正向”、“逆向”或“不”)。
Ⅱ、写出下列元素基态原子的电子排布式:
①29Cu____________________
②32Ge(简式)____________________
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合初中化学和生物学科的知识,回答下列问题。
| 配料表 |
精制海盐、碘酸钾 |
| 含碘量 |
20~40mg/kg |
| 卫生许可证号 |
××卫碘字(1999)第001号 |
| 分装日期 |
见封底 |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹调时,待食品熟后加入碘盐 |
(1)碘是合成下列哪种激素的主要原料之一()
A.胰岛素 B.甲状腺素 C.生长激素D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患()
A.甲状腺亢进B.贫血症C.地方性甲状腺肿大 D.糖尿病
(3)食盐中加碘,这碘指的是 (填元素、原子或单质)。
(4)碘酸钾的化学式为KIO3,其中碘元素的化合价为____________。
(5)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易______ ____。
(6)已知可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾(进行如下反应:IO3-+5I-+6H+==3I2+3H2O)。现有①纯净水、②白酒、③食醋、④淀粉KI试纸、⑤纯碱,试从中选择必须的物质检验食盐样品中是否加入碘,选择的物质_______________(填序号)。
有如下有机物:
①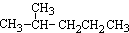 ②
②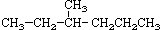 ③
③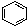
④CH3CH=CHCH3 ⑤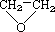 ⑥
⑥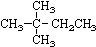 ⑦
⑦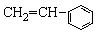
(1)互为同分异构体的是:__________,存在手性异构体的是:____________,存在顺反异构体的是__________,互为同系物的是(任写一对):__________;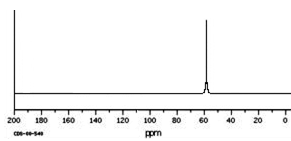
(2)氢核磁共振(1H-NMR)图谱如上图所示的有_______________________;
(3)上述物质中,不属于同分异构体,相同质量时,在氧气中完全燃烧消耗的氧气的质量完全相同的烃是:____________________;
(4)有机物④的系统命名法名称是_____________________;
(5)有机物⑤的键线式_____________,其分子中碳原子_______杂化。
恒温、容积为1 L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示[已知:2SO2(g) + O2(g)  2SO3(g) △H = - 196.6 kJ/mol ]。
2SO3(g) △H = - 196.6 kJ/mol ]。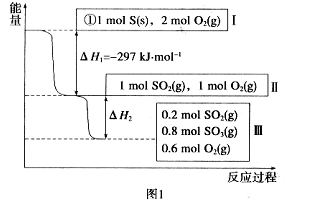
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:____________________。
(2)△H2 =" ____________" kJ/mol。
(3)在相同条件下,充入1 mol SO3和0.5 mol O2,则达到平衡时SO3的转化率为_________;此时该反应_______(填“放出”或“吸收”)________ kJ的能量。
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)反应过程中测定的部分数据见下表
CO2(g)+H2(g)反应过程中测定的部分数据见下表
| 反应时间/min |
n(CO)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)若保持其他条件不变,起始时向容器中充入0.60molCO(g)和0.30 molH2O(g),到达平衡时,n(CO2)= mol。
(3)若保持其他条件不变,向平衡体系中再通入H2O(g) 、CO2(g)各0.10mol,达到新平衡时CO2(g)的体积分数为 。
(4)若温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热” )。