锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害。对废旧电池进行资源化处理显得非常重要。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为_________________________________________________________。
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是___________。
(3)操作A的名称为_____________ 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有___________mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:________________。
(5)铜帽溶解时加入H2O2的目的是_______________________________(用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
根据上图可知:
①pH对Hg吸收率的影响规律是__________________________________________________.
②在强酸性环境下Hg的吸收率高的原因可能是_____________________________________.
工业上用丁烷氧化法制醋酸,反应的化学方程式可表示为:
2C4H10+5O2 4CH3COOH+2H2O
4CH3COOH+2H2O
现用58吨丁烷为原料制取醋酸,求:
(1)理论上需要标准状况下的空气m3(设空气中O2、N2的体积分数分别为0.2、0.8),同时生成水吨。
(2)若生成的醋酸溶解在生成的水中,所得醋酸的质量分数为%(保留两位有效数字)。
(3)若同时生产质量分数为50%的醋酸m1吨和质量分数为100%的冰醋酸m2吨,若不额外补充水,则m1+m2=__________吨。
有机物A为羊肉的特征香成分。其合成路线如下: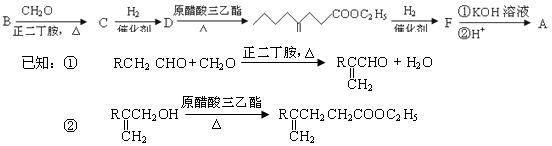
(1)B的结构简式为。
(2)下列关于D的说法中正确的是(填序号)。
① 能发生消去反应 ② 能使溴的四氯化碳溶液褪色
③ 结构中存在一个手性碳原子 ④ 分子式为C7H14O
(3)B→C的化学反应方程式为。 (4)与C含有相同官能团,分子结构中含有一个,,核磁共振氢谱有3个峰,且峰面积之比为9︰2︰1的同分异构体的结构简式为。
(4)与C含有相同官能团,分子结构中含有一个,,核磁共振氢谱有3个峰,且峰面积之比为9︰2︰1的同分异构体的结构简式为。
(5)请设计合理方案,完成从 到
到 的合成路线(用流程图表示,并注明反应条件)。
的合成路线(用流程图表示,并注明反应条件)。
提示:①利用题目中给出的已知信息;
②合成过程中无机试剂任选:
③合成路线流程图示例如下:
现有甲、乙、丙、丁四种物质,乙、丁的焰色反应均为黄色。丙是一种强酸的酸式盐,将丙加入BaCl2溶液有不溶于盐酸的白色沉淀生成,丁晶体在干燥空气中容易逐渐失去结晶水变成白色粉末。对甲、乙、丙、丁进行下列实验,实验过程和记录如下图所示(无关物质已略去),请回答: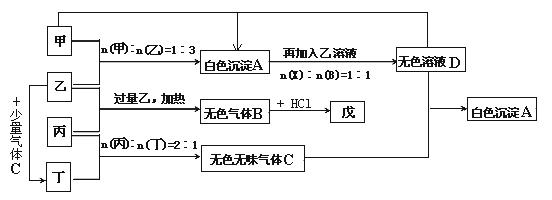
(1)将D溶液蒸干得到的固体是: (写化学式)。
(2)C的结构式是 。
(3)写出D溶液与过量的C反应的离子方程式。
(4)电解戊的水溶液一段时间后,收集到的三种气体为无色气体B和两种单质气体,写出电解戊溶液的总方程式:。
(5)有人设想在适当大小的管道中填充一定量的丁的晶体(摩尔质量在280∽300之间),管道环绕在一个房子的周围,这样的房子白天晚上室内温度可保持相对恒定,请简述其原理: 。
(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1=" —285.8" kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=" —889.6" kJ/mol
H2O(l)=H2O(g) △H3=" +44.0" kJ/mol
第③步反应的热化学方程式为。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为,溶液中H+向极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C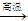 4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g)  C(g) + D(g) △H =" Q" kJ·mol-1
C(g) + D(g) △H =" Q" kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D
锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下: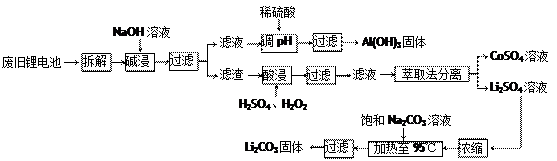
(1)上述工艺回收到的产物有Al (OH)3、。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是。
(3)酸浸时反应的化学方程式为。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是。
(4)生成Li2CO3的化学反应方程式为。已知Li2CO3在水中的溶解度随着温度的升高而减小,所以在浓缩结晶后要过滤。