下列关于原电池的叙述中,错误的是
| A.用导线连接的两种不同金属同时插入液体中,就能形成原电池 |
| B.原电池是将化学能转化为电能的装置 |
| C.在原电池中,电子流出的一极是负极,发生氧化反应 |
| D.在原电池中,电子流入的一极是正极,发生还原反应 |
符合图中阴影部分的物质是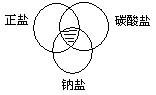
| A.Na2CO3 | B.Cu2(OH)2CO3 | C.NaCl | D.NaHCO3 |
某探究小组在某温度下测定溶液的pH值时发现,0.01mol/L的 NaOH溶液中,由水电离出的c(H+)·c(OH-) = 10-22,则该探究小组在该温度下测得0.01mol/L的 NaOH溶液的pH值应为
| A.13 | B.12 | C.11 | D.10 |
反应2A(g) 2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
| A.降温 | B.减压 | C.减少E的浓度 | D.加压 |
汽车尾气净化中的一个反应如下: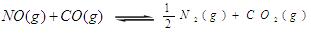 ,
,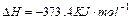 ,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:
,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:
A B C D
合成氨反应为N2+3H2 2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)
2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)
A. 恒温恒容:操作1:加1 mol N2+3 mol H2,操作2:加2 mol NH3
B. 恒温恒压:操作1:加1 mol N2+3 mol H2,操作2:加2 mol NH3
C. 恒温恒容:操作1:加1 mol N2+3 mol H2,操作2:加3 mol NH3
D. 恒温恒压:操作1:加1 mol N2+3 mol H2,操作2:加3 mol NH3