标准状况下分别向甲、乙、丙三个容器中加入30.0 mL同浓度的盐酸,再加入不同质量的由两种金属组成的同种合金粉末,测量放出气体的体积。另在甲、乙、丙三个容器中加入30.0 mL与盐酸同浓度的氢氧化钠溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积。所得数据如下表所示:
| 反应容器 |
甲 |
乙 |
丙 |
| 合金的质量/g |
0.510 |
1.53 |
3.57 |
| 与盐酸反应产生气体的体积/L |
0.560 |
0.672 |
0.672 |
| 与氢氧化钠反应产生气体的体积/L |
0.336 |
x |
y |
根据表中数据不可能得出的结论是
A.盐酸的物质的量浓度为2 mol·L-1 B.合金可能由镁与铝组成
C.x=2.016 D.y=2.016
下列说法正确的是
| A.淀粉、纤维素、油脂、蛋白质都属于天然高分子形成的混合物 |
B.蔗糖溶液中加入新制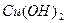 浊液煮沸会析出红色沉淀 浊液煮沸会析出红色沉淀 |
C.纤维素、淀粉都可用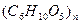 表示,但它们并不为同分异构体 表示,但它们并不为同分异构体 |
| D.人体的各种组织的蛋白质不断分解,最终生成二氧化碳和水,排出体外 |
下列转化不属于煤或石油的综合利用的是
| A.将煤干馏制得煤焦油和焦炭 |
| B.在一定条件下将煤与氢气转化为液体燃料 |
| C.将煤变为煤饼作燃料 |
| D.将石油裂解制得乙烯等化工原料 |
取一支大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,用铁架台固定好。放在光亮处一段时间。下列对观察到的现象的描述及说明正确的是
| A.试管中气体颜色变浅,是因为发生了加成反应 |
| B.试管中有少量白雾生成,这是氯化氢的小液滴 |
| C.试管内壁出现油状液体,这是甲烷与氯气的混合溶液 |
| D.试管内壁出现油状液体,这是CH3Cl小液滴 |
一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z(g),达到反应限度的标志是
Y(g)+Z(g),达到反应限度的标志是
①X的分解速率与X的生成速率相等②反应容器中压强不再变化
③X、Y、Z的浓度不再变化④单位时间内生成lmolY的同时生成lmolZ
| A.①③ | B.②③ | C.①② | D.②④ |
反应3X(g)+Y(g) 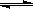 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率v为
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率v为
| A.V(X)=0.05mol·L—1·min—1 | B.V(Y)= 0.10mol·L—1·min—1 |
| C.V(Z)=0.10mol·L—1·min—1 | D.V(W)=0.05mol·L—1·s—1 |