丙烯是重要的化工原料,以丙烯为原料合成某种有机玻璃和油墨材料DAP-A树脂的流程如下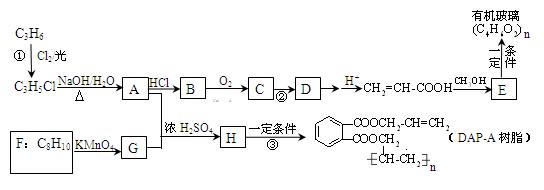
回答问题:
(1)写出下列物质可能的结构简式:B_________________,F_________________。
(2)写出反应类型:反应②______________;反应③____________________。
(3)1 mol DAP-A树脂在一定条件下与H2发生加成反应,最多消耗H2______mol。
(4)写出反应①的化学方程式___________________________________。
(5)写出G在一定条件下与乙二醇发生反应生成一种高分子化合物的化学方程式 。
(6)E的同分异构体中,属于酯类的链状有机物有 、
、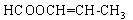 、___________________________________。
、___________________________________。
有X、Y、Z三种单质和甲、乙、丙三种常见的化合物,它们有如下图及叙述所示的关系,据此回答下列问题:

(1)X、Y、Z都是短周期元素的单质,X元素原子的最外层电子数是其次外层电子数的2倍;Y元素有两种常见单质,二者质量相等时其物质的量之比为3 :2;Z元素原子的次外层电子数是其最外层电子数的4倍。则:
①写出化合物甲的电子式__________;②写出Z与甲反应的化学方程式_____________。
(2)X、Y、Z都是非金属单质,X是原子晶体,Y、Z都是分子晶体,X、Y都能与强碱溶液反应;乙的水溶液是工业三酸之一,也是实验室常用试剂。则:
①写出X与NaOH溶液反应的离子方程式__________________________________;
②Z与甲的反应的一种重要工业用途是_____________________________________;
③在①所得溶液中加入乙的溶液,观察到的现象______________________________。
(3)X、Z是常见金属,Z与甲的反应只有在高温下才能进行,甲是一种具有磁性的化合物,乙在工业上常用于制取Z单质。则:
①写出乙与NaOH溶液反应的化学方程式__________________________;
②将①所得溶液与小苏打溶液的混合观察到的现象___________________________;
③将等物质的量的X和Z分别与足量的稀硫酸反应,当两种金属完全溶解后,得到气体的质量之比是____________________________。
化学式为C8H1018O的化合物A具有如下性质:
①A+Na→产生气泡 ②A+RCOOH→有果香味的产物
③A能使KMnO4酸性溶液褪色(被氧化为苯甲酸)
④A的催化氧化产物不能发生银镜反应
⑤A脱水反应的产物经聚合可制成一种塑料制品
(1)A中含氧官能团的名称是,性质⑤中脱水反应的反应类型是。
(2)A的结构简式是,写出三种A的同分异构体的结构简式,它们均能与NaOH反应且苯环上的一溴代物均只有两种。
(3)A与甲酸反应的方程式(必须注明18O的位置)。
(4)A脱水后的产物发生聚合反应的产物的结构简式。
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下: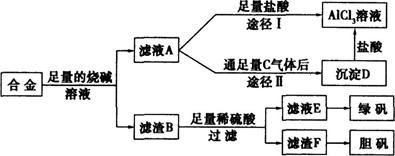
试回答下列问题:
(1)过滤用的器材已有:滤纸、铁架台、铁圈、烧杯和玻璃棒,还要补充的玻璃仪器是 。
(2)如何用实验证明沉淀D已洗涤干净 。
(3)由滤液A制得AlCl3溶液有途径I和Ⅱ两条,你认为合理的是途径 (填写“I”或“Ⅱ”),理由是;请写出途径Ⅱ得到沉淀D的离子方程式 。
(4)从滤液E中得到绿矾晶体的实验操作是蒸发浓缩、 、过滤。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,但前者的方案更合理,理由是 。
| A.后者消耗的酸和碱更多 | B.后者难以实现物质分离 |
| C.前者制得的产物更纯净 | D.前者操作步骤更少,方案简单 |
已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
请填空:
(1)反应①的化学方程式是。
(2)反应④的离子方程式是。
(3)写出反应③的化学方程式并标明电子转移方向及数目。
(4)设计实验证明反应③的气体产物中既有B,又有C,可将气体依次通过:溶液Ⅰ、酸性高锰酸钾溶液、溶液Ⅰ、溶液Ⅱ,则溶液Ⅰ和溶液Ⅱ分别为(填试剂名称):、,实验中两次使用溶液Ⅰ的作用分别是,。
(5)在工业生产上规定:空气中C的最大允许排放浓度不得超过0.02mg/L。
某同学拟用下列简易装置测定空气中C的含量:准确移取50mL 1×10-4mol/L的标准碘水溶液,注入下图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。反应中碘发生的变化为I2→HI。
①写出C与碘水反应的化学方程式;
②若测得抽气次数为100,则空气中C的含量为mg/L;
③乙同学抽气的次数至少为次,方可说明该地空气中C的含量符合排放标准。
有关中学常见元素X、Y、Z、D、E的信息如下:
| 元素 |
有关信息 |
| X |
元素主要化合价为-2 |
| Y |
所在主族序数与所在周期序数之差为4 |
| Z |
与X同主族,其单质在X的单质中燃烧,发出蓝紫色火焰 |
| D |
最高价氧化物既能溶于强酸又能溶于强碱 |
| E |
单质是生活中常见金属,其制品在潮湿的空气中易被腐蚀或损坏 |
用化学用语回答下列问题:
(1)X在元素周期表中的位置 ;画出Y的离子结构示意图 ;
(2)Y、Z的最高价氧化物对应的水化物酸性较强的是(填化学式) ;
X、Y、D形成的简单离子的半径由大到小为(填离子符号) 。
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 ,D的最高价氧化物溶于强碱的离子方程式 。
(4)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号) 。
①保存EY2溶液时,需向溶液中加入少量E单质
②EY2只能通过置换反应生成,EY3只能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
(5)E单质在潮湿空气中被腐蚀的正极反应式为 。