Fe、Ca是重要的金属元素。运用所学知识,回答下列问题。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式: ;
(2)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是 ;
②验证该溶液中含有Fe2+,正确的实验方法是 ;
A.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
C.观察溶液是否呈浅绿色
(3)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3~2.7×10-3mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。
(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
①配制5.0×10-3 mol·L-1KMnO4 200mL溶液,需要称取KMnO4固体的质量是 g;
②每消耗草酸0.5mol,转移电子的物质的量为 mol;
③此人血液中的Ca2+的浓度为 mol·L-1。
写出下列各烃的名称(8分,采用系统命名法)
(1)(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3(2)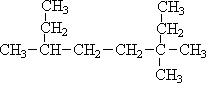
(3)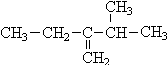 (4)
(4)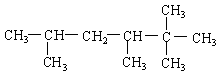
(7分每空1分)选择下列某种答案的序号, 填入下表的空格
①同位素②同素异形体③同分异构体④同系物⑤同种物质
| 物质 名称 |
丁烷与 2--甲基丙烷 |
红磷 与白磷 |
庚烷与 十六烷 |
氯仿与 三氯甲烷 |
氕与 氘、氚 |
新戊烷与 2,2--二甲基丁烷 |
2--甲基戊烷与 2,3--二甲基丁烷 |
| 相互 关系 |
请同学们根据官能团的不同对下列有机物进行分类。把正确答案填写在题中的横线上
(1)芳香烃:;
(2)卤代烃:;
(3)醇:;
(4)酚:;
(5)醛:;
(6)酮:;
(7)羧酸:;
(8)酯:。
已知Ksp[Ca(OH)2] = 5.5×10-6 mol3·L-3,则其饱和溶液的pH值是。
在CaCO3沉淀中加入HAc溶液,有现象,其离子反应式是。沉淀溶解的原因是。在PbI2沉淀中,加入Na2S溶液后,现象为其离子反应式是。沉淀溶解的原因是。