在CaCO3沉淀中加入HAc溶液,有 现象,其离子反应式是 。沉淀溶解的原因是 。在PbI2沉淀中,加入Na2S溶液后,现象为 其离子反应式是 。沉淀溶解的原因是 。
A、B、C、D、E原子序数依次递增的五种短周期元素,已知:
①B原子核外电子总数与最外层电子数之比为4:3
②D原子最外层电子数与次外层电子数之比为3:4
③E-,C+,A+的离子半径逐渐减小
④A单质在E单质中燃烧火焰呈苍白色
请回答下列问题:
(1)E的最高价氧化物对应水化物的化学式为:___________。它的酸性比D的最高价氧化物对应水化物的酸性:____________。(填“强”或“弱”)
(2)X、Y是由上述元素中任意3种组成的强电解质,且构成的原子个数比均为1:1:1。已知X溶液中水电离出来的C(H+)=10-12mol/L,则X的电子式为:_____________;Y的水溶液酸碱性与X相同,则其原因是(写离子方程式):_______________________________;
(3)B与C构成原子个数比为1:1的化合物与H2O反应的化学方程式为:__________________________________________;
(4)A与B,A与D均可形成18个电子的分子,这两种分子在水溶液中反应生成物之一是含10电子的化合物;该反应可观察到现象是:____________________________________,原因是(用化学方程式表示)_______________________________________________。
有机高分子化合物甲是
一种常用的光敏高分子材料,其结构简式为: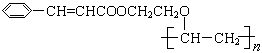 。
。
按图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。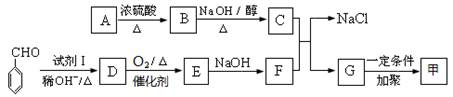
已知:
①-CH2OH + -CH2OH 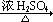 -CH2OCH2- + H2O
-CH2OCH2- + H2O
②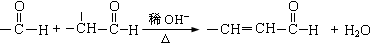
回答下列问题:
(1)试剂Ⅰ的名称是;B→C的反应类型是;
(2)质谱图显示A的相对分子质量是80.5;A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2:2:1,则A的结构简式为。
(3)写出下列反应的化学方程式。
①D→E的反应;
②C与F的反应。
(4)E的一种同分异构体,水解产物有两种,一种能使溴水褪色,另一种在滴加饱和溴水后,有白色沉淀生成,该物质的结构简式为。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)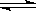 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v (CO2)表示的反应速率为(取小数二位,下同)。
②该反应为(填“吸”或“放”)热反应,实验2条件下平衡常数K=。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
⑷某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。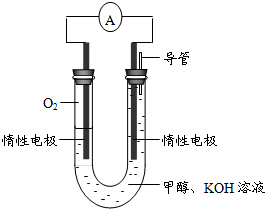
①该电池正极的电极反应为。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为。
A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。回答下列问题:
(1)B中的化学键有,(填“离子键”、“极性键”或“非极性键”) E的电子式。
(2)写出反应⑦的离子方程式__________________________
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴或阳”)
极附近溶液由无色变为红色,其原因是
2011年6月20日我国卫生部正式实施了GB2760-2011《食品安全国家标准食品添加剂使用标准》,对部分食品添加剂的使用规定进行了调整。食品添加剂F1和F2的制备流程分别如下(部分反应条件略)。
(一)F1的制备流程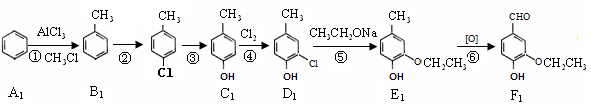
(1)、属于氧化反应的有_______(填写反应序号)。反应②的化学反应方程式是:。
(2)、B1中有少量A1,分离的方法是:。
(3)、F1在适当的氧化剂作用下,得到产物C9H10O4,酸性增强,该产物在一定条件下发生聚合反应,聚合产物的结构简式为_______________________。
(二)F2的制备流程
已知:①烃A2常作为切割金属的燃料。
②同一碳原子上有两个羟基的化合物不稳定,易脱水生成醛或酮: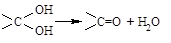
③醛 与醛
与醛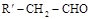 在一定条件下反应,可得到
在一定条件下反应,可得到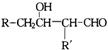
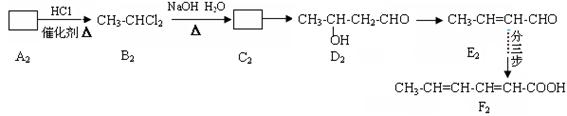
(4)、写出C2结构简式: ___________;B 2的同分异构体的名称:__________。
(5)、与D2互为同分异构体、分子中含两个甲基的酯共有_______种。
(6)、E2→F2的三步反应中的前两步反应与C2→D2→E2的反应过程相似。完成E2→F2第二步反应的化学方程式: 。