根据反应8NH3+3Cl2=6NH 4Cl+N2,回答下列问题:
4Cl+N2,回答下列问题:
⑴该反应中氧化剂是 ,被氧化的是 元素。
⑵该反应中参加氧化还原的氧化剂与还原剂的物质的量之比为
⑶用双线桥法标出电子转移的方向与数目。
(12 分)能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(l)已知:在 25 ℃、101 kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ 。请写出甲醇燃烧的热化学方程式。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+ 3H2 (g)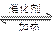 CH3OH(g)+H2O (g ).在其它
CH3OH(g)+H2O (g ).在其它 条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)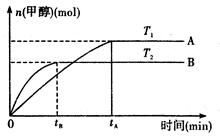
①合成甲醇反应的△H0。(填“>”、“<”或“=”)。
②平衡常数的表达式为:.温度为T2时的平衡常数温度为T1时的平衡常数(填“>”、“<”或“=”)
③在T1温度下,将1mol CO2和 1 molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强的比值为。
(3)利用甲醇燃料电池设计如下图所示的装置。
该装置中 Pt 极为极;写出 b极的电极反应式.
铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,3 mol FeS2参加反应转移mol电子。
6SO2+Fe3O4,3 mol FeS2参加反应转移mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式。
从腐蚀废液回收得到金属铜还需要的试剂为_________________________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是。
(4)下表中,对陈述I、II的正确性及其有无因果关系的判断都正确的是____。(填字母)
| 选项 |
陈述I |
陈述II |
判断 |
| A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
I对;II对;有 |
| B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
I对;II对;无 |
| C |
铁属于过渡金属元素 |
铁和铁的某些化合物可以用作催化剂 |
I错;II对;无 |
| D |
铁在空气中表面生成致密氧化膜 |
可用铁罐储存运输浓硫酸、浓硝酸 |
I对;II对;有 |
有机物A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的59倍,在催化剂存在下,1mol B可以和4mol H2发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系如下:
(1)反应①属于反应,反应②属于反应
(2)写出A2物质的结构简式:A2
(3)书写化学方程式:
③④⑤
(4)化合物E有多种同分异构体,其中属于酯类且具有两个对位侧链的同分异构体有四种,分别写出它们的结构简式: ;;;。
;;;。
将标准状况下的NH3 700L溶于1L的水中,所得溶液的密度为0.90g/cm3,则所得氨水的物质 的量浓度为mol/L
的量浓度为mol/L
有机物A的结构简式如右图:
⑴、A与过量NaOH完全反应时,A与参加反应的NaOH物质的量的比为.
⑵、A与新制的Cu(OH)2完全反应时,A与参加反应的Cu(OH)2的物质的量的比为
其中A与被还原的Cu(OH)2的物质的量的比为
⑶、A与过量的NaHCO3完全时,A与参加反应的NaHCO3的物质的量的比为。