1828年,德国化学家维勒进行了下列实验,揭开了人工合成有机物的序幕。填写下列空白:
(1)用NH4Cl与AgCNO制取氰酸铵(NH4CNO),反应的化学方程式为: ,该反应属于 反应。
(2)蒸发氰酸铵(NH4CNO)的水溶液得到尿素[CO(NH2)2],反应方程式为: ,该反应实现了从 向 的转化。
(16分)氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
⑴以前采用无隔膜电解冷的食盐水时,Cl2会与NaOH接触,产物中肯定有NaClO,从而影响产品的纯度。能包含这一过程的总反应方程式为
⑵现代氯碱工业多采用隔膜法进行电解,即用隔膜将电解槽分隔成阳极区和阴极区,则从阴极区排出的是,电解时用盐酸控制阳极区的PH在2~3,用化学平衡移动原理解释盐酸的作用:
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。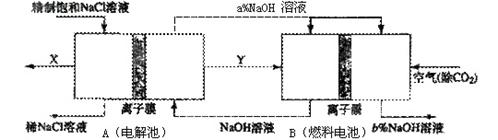 ①分析比较图中氢氧化鈉质量分数大小:a%(填“>”、“<”或“=”) b%,理由是
①分析比较图中氢氧化鈉质量分数大小:a%(填“>”、“<”或“=”) b%,理由是
②这样设计的主要节(电))能之处在于(至少写一处)
⑷科研人员为减少火力发电厂对环境的污染,曾经考虑让火力发电厂和氯碱厂进行就近联合。请你判断该方案是否可行?(填可行或不可行),理由是
(12分)随着氮氧化物污染的日趋严重,我国将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法:
(1)用活性炭还原法处理氮氧化物。有关反应为:C(g)+2NO(g) N2(g)+CO2(g)△H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
N2(g)+CO2(g)△H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
| 浓度/mol•L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①T1℃时,该反应的平衡常数K=(保留两位小数)
②30min后,改变某一条件,经过一段时间后反应重新达到平衡,则改变的条件可能是
③若30min后升高温度至T2℃,达到平衡时,容器中的NO、N2、CO2的浓度之比为5:3:3,则该反应的△H(填“>”、“<”或“=”)0
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H20(g)△H=-574kJ.mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ.mol-1
③H2O(g)=H2O(l)△H=-44.0kJ.mol-1
写出CH4和NO2反应生成N2(g) 、CO2(g)和 H2O(l)的热化学方程式:
(3)选择性催化还原(SCR)脱硝技术是目前应用最广、最有效的烟气脱硝技术之一。该技术涉及以下反应:4NO(g)+4NH3(g)+ O2(g)=在4N2(g)+ 6H2O(g),在恒容的密闭容器中,下列有关说法中正确的是(填字母)
A.其他条件不变,使用高效催化剂,烟气中NO的转化率增大
B.单位时间内消耗NH3和NO的物质的量之比为1:1时,反应达到平衡
C.其他条件不变时升高温度,反应的平衡常数减小
D.反应达到平衡后,再向容器中充入等量的反应物,再次达到平衡时,NO的转化率减小
(4)以NO2 、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,该电极的电极反应可表示为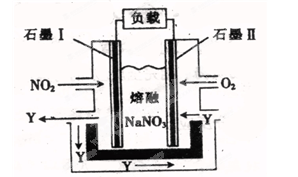
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)Y的元素符号是
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键,中心原子杂化轨道类型;在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。此反应的化学方程式是 。
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:
_____________________________________________________________________________________________________________________________________。
缓冲溶液可以抵抗少量酸或碱对溶液PH的影响。人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),以维持血液PH的稳定。已知人体正常体温时,H2CO3 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7则下列判断正确的是
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7则下列判断正确的是
| A.正常人血液内Kw=10-14 |
| B.由题给数据可算得正常人血液的pH约为7.4 |
| C.正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) |
| D.当过量的碱进入血液中时,只发生反应:HCO3-+OH—=CO32-+H2O |
A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
| 物质组成 |
甲 |
乙 |
丙 |
丁 |
| 化合物中各元素 原子个数比 |
A和C 1:1 |
B和A 1:4 |
D和E 1:3 |
B和E 1:4 |
请回答下列问题:
⑴C的氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示): _____>___
⑵元素E在周期表中的位置为第周期族
⑶请写出两种与乙具有相同电子数的非单核离子的化学式:_____和_____
⑷把D的单质放到NaOH溶液中,反应的化学方程式为:______________________
⑸写出甲的电子式:________________
⑹有200mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3 mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是: _____