现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| X |
X+具有与Ne原子相同的电子层结构 |
| Y |
最外层电子数是次外层的一半,其最高正价与最低负价的绝对值相等 |
| Z |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T |
元素单质的颜色是黄绿色的气体 |
(1) Y在周期表中的位置是 ,Z的原子结构示意图是 。
(2) X元素与T元素形成化合物的电子式是 。
(3) X的最高价氧化物对应水化物的化学式是 ,化学键类型有 。
(4) Y和Z的最高价氧化物对应的水化物中酸性较强的是 (填化学式)
写出可以验证该结论的一个简单易行的实验方案
。
从海水中可提取多种化工原料,下面是某化工厂对海水的几项综合利用流程图: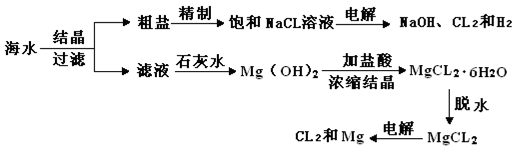
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序中正确的是(填字母)。
| A.①②③④ | B.②③④① | C.②④③① | D.③④②① |
(2)为了降低生产成本,可用海滩上含CaCO3的贝壳制备Ca(OH)2,有关反应的化学方程式为
(3)写出电解饱和NaCl溶液的化学方程式:
煤干馏制得的煤焦油中含一种烃A,A的相对分子质量为128,则其分子式可能是________或________。若A是易升华的块状晶体(芳香烃),则其结构简式可能为________。
为除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)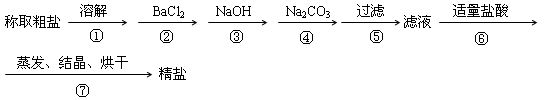
(1)判断BaCl2已过量的方法是
(2)在第⑥步中,写出所有反应的化学方程式
(1)同温同压下,两种气体A和B的体积之比为2:1,质量之比为8:5,则A与B的密度之比为,摩尔质量之比为。
(2)在标准状况下a. 6.72L CH4气体 b.3.01×1023个HCl气体分子 c.13.6g H2S气体 d.0.2molNH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)
①四种气体的物质的量,
②标准状况下四种气体的体积,
③四种气体的质量。
(6分)物质的量相等的 CO 和 CO2中,分子个数之比为 ____;原子个数之比为 _________;氧原子个数比为。