现用质量分数98%密度为1.84 g·cm-3浓H2SO4来配制450 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管
⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
⑴上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
⑵经计算,需浓H2SO4的体积为 。
现有① 5 mL ②10 mL ③20 mL ④50 mL三种规格量筒,你选用的量筒是 (填代号)。
⑶在配制过程中,下列操作错误的是 (填代号),
其他操作都准确,下列操作能引起误差偏高的有 (填代号)。
①将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③洗涤溶解用的烧杯与玻璃棒,并将洗涤液转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.2000mol·L -1的氢氧化钠溶液(指示剂为酚酞),滴定结果如下:
| NaOH起始读数 |
NaOH终点读数 |
|
| 第一次 |
0.10mL |
18.60mL |
| 第二次 |
0.30mL |
18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
(2)达到滴定终点的标志是 。
(3)以下操作造成测定结果偏高的原因可能是 。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
Ⅰ.甲图是几种实验中常用的仪器:
写出序号所代表的仪器的名称:
A___________;B___________;
C___________;D___________。
Ⅱ.实验室要配制450 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有______________(填选项的字母)。
A.烧杯 B.500 mL容量瓶
C.胶头滴管 D.漏斗 E.玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)取用任意体积的该NaOH溶液时,下列物理量中不随所取体积的多少而变化的是__________。
A.溶液的浓度B.溶液中NaOH的物质的量
C.溶液的密度 D.溶液中OH-的数目
(4)在配制上述溶液的过程中,下列情况对NaOH溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”
①转移溶液后烧杯玻璃棒未进行洗涤就进行定容_____________________
②氢氧化钠在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容__________________
③在容量瓶中定容时仰视容量瓶刻度线__________________
④容量瓶洗涤后未干燥即用来配制溶液__________________
实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据: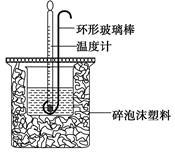
| 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
NaOH溶液 |
||
| 1 |
20.2 |
20.3 |
23.7 |
| 2 |
20.3 |
20.5 |
23.8 |
| 3 |
21.5 |
21.6 |
24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是:________,该装置中发生反应的化学方程式为________________________。
(2)实验过程中,装置乙、丙中出现的现象分别是________ ;_____________ 装置丙中的试管内发生反应的离子方程式为_______ 。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体;通入的这种气体的名称是________。
某学生为了探究钠与CO2的反应,利用如图装置进行实验。(已知PdCl2能被CO还原得到黑色的Pd)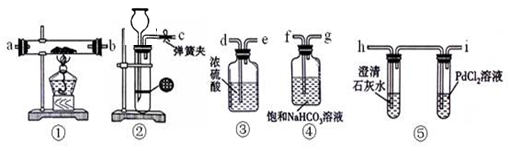
(1)请将上图各装置连接完整(填写装置中字母):c接f, 接 , 接 , 接 。
(2)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是 。
| A.H2SO4溶液 | B.CCl4 | C.苯 | D.稀硝酸 |
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到 时再点燃酒精灯。
(4)若反应过程中CO2足量,探究钠与CO2充分反应后,生成的固体物质的可能的情况,某同学提出以下猜想:
① 生成的固体物质为Na2CO3
② 生成的固体物质为Na2CO3和C的混合物
③ 生成的固体物质为Na2CO3和Na2O的混合物
④ 生成的固体物质为Na2O和C的混合物
你认为正确的是 (填序号)。
假如反应过程中有下列两种情况,分别写出两种情况下钠与CO2反应的化学方程式。
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体: ;
Ⅱ.装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,且溶液中还有固体残留: 。