美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下: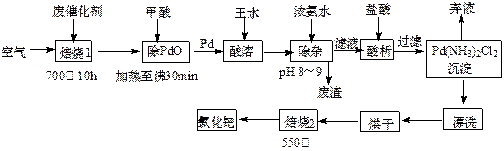
(1)甲酸在反应中的作用是 (选填:“氧化剂”或“还原剂”);
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是 (写化学式);
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
①气体B的化学式为 ,
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%。则A的化学式为 ;
(4)700℃“焙烧1”的目的是 ,550℃“焙烧2”的目的是 。
在120 ℃时分别进行如下四个反应:
| A.2H2S+O2====2H2O+2S↓ | B.2H2S+3O2====2H2O+2SO2 |
| C.C2H4+3O2=====2H2O+2CO2 | D.C4H8+6O2====4H2O+4CO2 |
(1)当反应在容积固定的容器内进行,反应前后气体密度(d)的气体总压强(p)分别符合关系式d前=d后和p前>p后的是____________;符合关系式d前=d后和p前=p后的是__________。(请填写反应的代号)
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是________,符合d前>d后和V前>V后的是_______。(请填写反应的代号)
如图:在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0 mol,D为6.5 mol,F为2.0 mol,设E为x mol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于正中位置。请填写以下空白: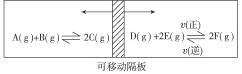
若x=4.5,则右侧反应在起始时向____________(填“正反应”或“逆反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于______________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量_________(填“相等”“不相等”或“不能确定”)。其理由是_______________。
下图所示是可逆反应A+2B 2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况:
2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况: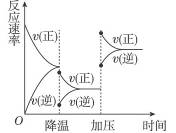
由图可判断:
(1)正反应是_____________(吸热、放热)反应。
(2)若A、B是气体,则C的状态是__________,D的状态是______________。
钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l) NaCl(l)+K(g)-Q
NaCl(l)+K(g)-Q
各物质的沸点与压强的关系如下表。
| 压强/kPa |
13.33 |
53.32 |
101.3 |
| K的沸点/℃ |
590 |
710 |
770 |
| Na的沸点/℃ |
700 |
830 |
890 |
| KCl的沸点/℃ |
1 437 |
||
| NaCl的沸点/℃ |
1 465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为__________,而反应的最高温度应低于__________。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是______________。
已知4℃时四种化合物在水中和液氨中的溶解度如下表:
| AgNO3 |
Ba (NO3)2 |
AgCl |
BaCl2 |
|
| H2O(l) |
170g |
9.20g |
1.50×10-4g |
33.3g |
| NH3(l) |
86.0g |
97.2g |
0.80g |
0.00g |
①上述四种物质能在水中发生的复分解反应为___________________________;
②能在液氨中发生的复分解反应为_____________________________________。