维生素C对维持人体正常生理功能有重要作用,其分子式是C6H8O6 ,水溶液呈酸性,高温或较长时间受热易损耗。许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素
C,例如:新鲜橙果中的橙汁液中含维生素C浓度在500 mg·L-1左右。
某化学兴趣小组对标有“纯天然鲜橙原汁”的某市售橙汁中维生素C的含量进行了测定,请填写如下相关空白:
实验目的:测定市售××牌软包装纯天然鲜橙原汁饮料中维生素C的含量。
实验原理:C6H8O6 + I2 → C6H6O6 + 2 H+ + 2 I-。
实验用品和试剂:
部分可能用到的仪器如下:


A B  C
C
试剂:浓度为1.50×10-4mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
实验过程:
(1)洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤并需用标准液润洗的仪器有 (从上述A、B、C仪器中选择,填编号)。
(2)打开一袋橙汁包,目测:颜色——橙黄色,澄清度——好。准确量取20.00mL该汁液加入烧杯中溶解,并用100 mL (填仪器名称)定容配成100 mL稀橙汁。取洁净的 (从上述A、B、C仪器中选择,填编号),用上述稀橙汁润洗2~3次,并用该仪器取25.00mL稀橙汁入 中(从上述A、B、C仪器中选择,填编号),再加入约10mL蒸馏水充分摇匀,然后向其中加入2滴指示剂,应加指示剂的名称是 溶液。
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视 。滴定至终点时的现象是  。
。
(4)重复上述实验。
(5)数据记录和处理:
| 实验次数 |
稀橙汁体积(mL) |
滴定用标准碘(水)溶液(mL) |
| 1 |
25.00 |
23.10 |
| 2 |
25.00 |
23.00 |
| 3 |
25.00 |
22.90 |
从实验数据可知,该橙汁饮料中维生素C的含量为 mg·L-1
(6)假定该小组成员滴定终点时读数皆为俯视读数,则测定结果 (选填“偏高”或“偏低”或“无影响”)
下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑少量。填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出试管A中所发生反应的化学方程式(有机物写结构简式)______________ _______;
(2)试管C中苯的作用为________________________________________;
(3)反应2至3min后,在盛NaOH溶液的B中可观察到的现象为_________________________;
(4)在上述整套装置中,具有防倒吸作用的仪器有_____________ _______(填字母);
(5)能说明苯与溴发生的是取代反应而不是加成反应的现象为________ _________________。
(6分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室用教材的装置制取乙酸乙酯。回答下列问题:
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:。
(2)浓硫酸的作用是:①;②。
(3)饱和碳酸钠溶液的主要作用是。
(11分)醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的装置如下图所示,其中锥形瓶b是安全瓶,试管d中装有少量蒸馏水。已知溴乙烷的沸点为38.4℃,密度为1.43 g/mL;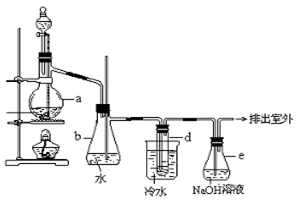
(1)制备溴乙烷需要用到蒸馏水、乙醇、溴化钠、浓硫酸,在烧瓶中加入这几种物质的顺序依次是________________________________。
(2)小火加热,在烧瓶中发生的主要反应有①____________________;②______________________。
(3)冷水的作用_______________________;d试管中的现象_______________________。
(4)用这种方法制取的溴乙烷中的含少量杂质Br2,欲除去溴代烷中的少量杂质Br2,下列供选试剂中最适合的是__________。
| A.NaI溶液 | B.NaOH溶液 | C.Na2SO3溶液 | D.KCl溶液 |
(5)容器e中NaOH溶液的作用是_____________________________________________。
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属 质量/g |
金属状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响,能表明同一规律的实验还有 (填实验序号);
(2)本实验中影响反应速率的除了浓度还有 ,仅表明该因素对反应速率产生影响的实验有 (填实验序号)。
(3)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因 。
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间。
(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式。
(2)经过几个小时的反应后,U型管右端的玻璃管中水柱变化是。
| A.升高 | B.降低 | C.不变 | D.无法确定 |
(3)甲烷通常用来作燃料,其燃烧反应的化学方程式是。
(4)若用甲烷—氧气构成燃料电池,电解质溶液为KOH溶液,试写出该电池的正极的电极反应式;负极的电极反应式。