下列有关生活和生产中的化学知识描述不正确的是
| A.使用纤维素和淀粉为原料制成的微生物降解塑料,可治理“白色污染” |
| B.发电厂的煤在燃烧时加入适量生石灰,有利于环境保护 |
| C.泄露在美国墨西哥湾海洋中的大量原油能被海洋生物迅速分解,不会导致生态灾难 |
| D.大力开发风能、太阳能、核能,有利于实现“低碳经济”,减少温室气体的排放 |
某温度下,将2 mol A和1 mol B放入一密闭容器中,发生反应:A(g)+B(g) 2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
A.该反应的化学平衡常数表达式是K= |
| B.若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 |
| C.增大该体系的压强,A的转化率增大 |
| D.该条件下B的平衡转化率是40% |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是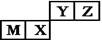
| A.原子半径Z<M |
| B.Z位于元素周期表中第二周期,第ⅥA族 |
| C.X的最简单气态氢化物的热稳定性比Z的小 |
| D.Y的最高价氧化物对应水化物的酸性比X的弱 |
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是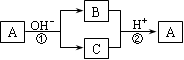
A.X元素一定为非金属元素 B.X元素可能为Al
C.反应①和②互为可逆反应D.反应①和②可能为氧化还原反应
已知25 ℃时,BaCO3的溶度积Ksp=2.58×10-9,BaSO4的溶度积Ksp=1.07×10-10,则下列说法不正确的是
| A.25 ℃时,当溶液中c(Ba2+)·c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和溶液 |
| B.因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3 |
| C.25 ℃时,在含有BaCO3固体的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析出,此时溶液中c(CO32-)∶c(SO42-)≈24.11 |
| D.在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变 |
能正确表示下列反应的离子方程式是
| A.醋酸钠的水解反应 CH3COO-+H3O+=CH3COOH+H2O |
| B.碳酸氢钙与过量的NaOH溶液反应 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| C.向FeBr2溶液中通入过量氯气 2Fe2++Cl2===2Fe3++2Cl- |
| D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |