某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是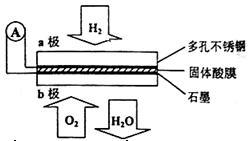
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为:O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。
已知(1)a、c、e均能与稀硫酸反应放出气体(2)b与d的硝酸盐反应,置换出单质d(3)c与强碱反应放出气体(4)c、e在冷浓硫酸中发生钝化。由此判断a、b、c、d、e依次为
| A.Fe、Cu、Al、Ag、Mg | B.Mg、Ag、Al、Cu、Fe |
| C.Al、Cu、Mg、Ag、Fe | D.Mg、Cu、Al、Ag、Fe |
酸根RO3-所含电子数比硝酸根NO3-的电子数多10。则下列说法正确的是
| A.R原子的电子层数比N的电子层数多2 |
| B.R元素的最高正化合价与NO3-中的N的化合价相等 |
| C.R所含电子数比N的电子数多10 |
| D.R和N为同族元素 |
下列方程式正确的是
| A.铁和稀硝酸反应:Fe + 2H+ = H 2↑+ Fe 2+ |
| B.向氯化铵的溶液中加入足量浓NaOH溶液并加热:NH4++OH-△NH3↑+H2O |
| C.Ba(OH)2溶液与H2SO4溶液混合产生沉淀:Ba2++ SO42-=BaSO4↓ |
| D.往NaOH溶液通入过量SO2: SO2+2OH-="=" SO32-+H2O |
下列除杂的操作方法,正确的是
| A.NH3中混有少量水蒸气:通过装有浓硫酸的洗气瓶 |
| B.CO2中混有少量SO2气体:通入NaOH溶液 |
| C.食盐固体中混有少量NH4Cl:加热 |
| D.硝酸混有少量硫酸:加适量BaCl2溶液后再过滤 |
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是次外层电子数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A元素非金属性由强到弱的顺序是: Z> Y>X
B.Y元素最高价氧化物对应水化物的化学式可表示为H4YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为 Z >Y>X