(10分)某校化学兴趣小组采用酸碱中和滴定法测定学校新购入的烧碱的纯度(烧碱中含有不与酸反应的杂质),试根据实验回答。
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品。
②将样品配 成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有______________________。
成250ml待测液,需要的仪器除玻璃棒、量筒、烧杯外还需要的玻璃仪器有______________________。
③用________、量取10.00ml待测 液,注入锥形瓶中。
液,注入锥形瓶中。
④在锥形瓶中滴入2~3滴________(填指示剂),用0.2010 mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转____式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。
(2)实验过程中,下列操作将造成待测烧碱溶液浓度偏高的是_______________。
①量取待测液的滴定管没有用待测液润洗 ②锥形瓶水洗后又用待测液润洗
③未用标准盐酸溶液润洗滴定管 ④滴定过程中振荡时有液滴溅出
⑤滴定前盛装标准盐酸溶液的滴定管尖嘴部分无气泡,滴定后有气泡
⑥滴定前仰视读数,滴定后俯视读数
(3)该小组测得下列数据
| 滴定次数 |
待测液体积/ml |
标准盐酸体积/ml |
|
| 滴定前读数/ml |
滴定后读数/ml |
||
| 第一次 |
10.00 |
0.20 |
22.90 |
| 第二次 |
10.00 |
0.50 |
20.40 |
| 第三次 |
10.00 |
4.00 |
24.10 |
| 第四次 |
10.00 |
0.00 |
20.00 |
根据上述数据,计算烧碱的纯度______________。
(8分)著名化学家罗伯特·波义尔(Robert Boyle)在一次实验中,不小心将盐酸溅到紫罗兰花瓣上,过一会儿,他惊奇地发现,紫色的花瓣上出现了红点。波义尔对这一意外的发现,作出了各种假设,经过多次实验验证,探究普遍规律,终于获得了成功。对紫罗兰花瓣遇盐酸变红的现象,你有哪些假设?请将你的各种假设和验证假设的实验方案填写在下表中。
某化学兴趣小组的同学利用下图所示实验装置进行NH3、Cl2的制备、性质等实验(图中夹持装置有省略)。请按要求填空。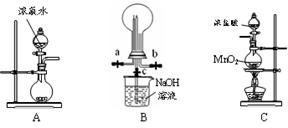
供选择的装置: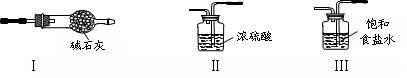
(1)装置A除可制备NH3外,还可制备其他多种气体,写出制备其中一种气体的化学方程式_____________________________________。
(2)为制取干燥氨气,可将装置A与装置________(填编号,从供选择的装置中选取)连接;装置A中的烧瓶内固体宜选用(选填以下选项的代号)。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(3)若欲制取纯净、干燥的氯气,可从I、II、III装置中选取合适的装置与C依次相连。则连接次序为C、_______(填编号);
(4)B为探究氯气与氨气反应的装置。实验时先向B通入氨气,然后关闭c活塞,再向B通入氯气。
①实验中装置B的烧瓶内出现浓厚的白烟并在容器内壁凝结,试推测发生反应的化学方程式_____________________________,请设计一个实验方案鉴定该固体中的阳离子;
②实验完毕后观察到B烧瓶内还有黄绿色气体,简述如何处理才能不污染环境。
某合作学习小组分别利用装置Ⅰ、Ⅱ探究铜与硝酸的反应。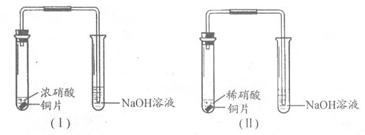
(1)Ⅰ中反应的离子方程式为;
Ⅱ中反应的化学方程式为;
比较装置Ⅰ、Ⅱ中的反应现象,其不同点是;
;
(2)该小组给Ⅰ反应后的溶液用小火加热一会儿,然后自然冷却。实验中观察到:试管上部气体颜色变深,并发现氢氧化钠溶液完全倒吸。倒吸后,试管中混合液呈淡蓝色,试管中有色气体消失。
①“试管上部气体颜色变深”的可能原因是;
②“倒吸”的原因是;
③“溶液呈淡蓝色”的可能原因是。
有一种催化剂为铁的常见的氧化物,为探究该氧化物的成分:
(一)某同学将适量稀硝酸加入少许样品中加热溶解;取少许所得溶液,滴加KSCN溶液,出现红色,由此得出该氧化物中铁元素为+3价,你认为该结论(合理或不合理),理由:。
(二)请你完成对该铁的氧化物成分的探究分析:
提出对该氧化物的合理假设:
a.假设1:;b.假设2:假设该氧化物为FeO;c.假设3:。
(三)[设计方案证明上述假设,选择合适的仪器和药品]
(四)[实验过程以及结论分析]:(请填写空格①和②)
| 实验操作 |
预期现象与结论 |
| 步骤1:用滴管取一定量3mol·L-1H2SO4于试管中,加热煮沸数分钟除去溶于其中的氧气 |
 |
| 步骤2:用药匙取少量样品于试管中,用滴管加入适量除去氧气的3mol·L-1H2SO4并加热,充分反应得A溶液 |
固体溶解,溶液颜色有变化 |
| 步骤3:取少许A溶液于试管中,滴加1—2滴20%KSCN溶液,振荡 |
① |
| 步骤4:另取少许A溶液于试管中,滴加1—2滴0.2mol·L-1KMnO4溶液,振荡 |
② |
某同学为测定黄铜矿的纯度(主要成分CuFeS2含少量SiO2),设计如下实验:称取2.0g研细的该黄铜矿样品,高温下和空气中的氧气充分反应: 6CuFeS2+19O2
6CuFeS2+19O2 6CuO+2Fe3O4+12SO2
6CuO+2Fe3O4+12SO2
生成的SO2进入D中和水发生反应:SO2+H2O=H2SO3;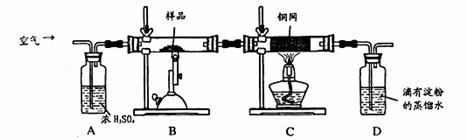
(1)称量该样品时用的仪器的名称为。
(2)装置A的作用;
a.有利于空气中氧 气充分反应 b.除去空气中的水份
气充分反应 b.除去空气中的水份
c.有利于气体混合 d.有利于观察空气流速
(3)装置B中反应结束后,仍需继续通一段时间空气的目的。
(4)实验后将D中的溶液全部转移至锥形瓶,用1.0mol/L的I2溶液进行滴定,反应为:H2SO3+I2 +H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为,通过计算,该黄铜矿的纯度为(Cu:64 Fe:56 S:32)
+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为,通过计算,该黄铜矿的纯度为(Cu:64 Fe:56 S:32)