下列有关化学反应现象和化学原理运用的叙述一定有误的是
| A.漂粉精的有效成分是Ca(ClO)2,Ca(ClO)2难分解,但漂粉精仍需密封保存 |
| B.不锈钢是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| C.无机非金属材料光导纤维能够被氢氟酸腐蚀 |
| D.石灰石高温煅烧能分解,与此反应是熵增反应有关 |
a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为①(a+b)×189g②Vc-(9a+b) mol③(a+b)mol ④Vc-(9a+b)/3mol
| A.①④ | B.②③ | C.①③ | D.②④ |
如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水(此法可快速制备氨气),立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是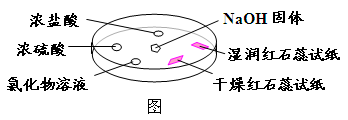
| 选项 |
实验现象 |
解释 |
| A |
浓盐酸附近产生白烟 |
NH3与浓盐酸反应产生了NH4Cl固体 |
| B |
浓硫酸附近无明显现象 |
NH3与浓硫酸不发生反应 |
| C |
氯化物溶液变浑浊 |
该溶液一定是AlCl3溶液 |
| D |
干燥红石蕊试纸不变色,湿润红色石蕊试纸变蓝 |
NH3是一种可溶性碱 |
将BaCl2溶液分别盛于两支试管中,第1支加入稀HNO3溶液,第2支加入烧碱溶液,然后再分别通入SO2气体,结果两试管均有白色沉淀产生。下列说法正确的是
| A.证明SO2具有强氧化性和酸性 |
| B.若第1支试管先通入Cl2,再通SO2气体,也有白色沉淀生成 |
| C.若第2支试管先通入NH3,再通SO2,不会产生沉淀 |
| D.若第1支试管中先加入稀HNO3溶液,再加入Na2SO3溶液,则无沉淀生成 |
下列表示方法错误的是
A.S2-的结构示意图: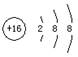 |
B.CO2的结构式:O=C=O |
| C.二氧化硅的分子式:SiO2 | D.乙烯的结构简式为CH2=CH2 |
为探究一溴环己烷( 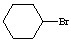 )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
| A.甲 | B.乙 | C.丙 | D.上述实验方案都不正确 |