下列离子方程式中正确的是
| A.Ba(OH)2溶液中加NaHSO4溶液至中性:Ba2+ + OH- + H+ + SO42- ="" BaSO4↓+ H2O |
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++ OH- NH3↑+ H2O NH3↑+ H2O |
| C.稀硝酸和过量的铁屑反应: Fe +4H+ + NO3- ="" Fe3+ + NO↑ + 2 H2O |
| D.KI溶液与H2SO4酸化的H2O2溶液混合:2 I- + H2O2 + 2 H+ ="2" H2O + I2 |
Na2CO3固体中有少量的NaHCO3固体,除去NaHCO3固体选用的最好方法是
| A.加入氢氧化钠 | B.通入CO2气体 | C.加热灼烧 | D.加入盐酸 |
下列变化属于物理变化的是
| A.煤的干馏 | B.金属的钝化 | C.石油的裂化 | D.碘的升华 |
某同学发现一瓶失去标签的药品,取出少量,观察到该药品为白色固体,加入蒸馏水后,发现白色固体全部溶解,他认为该药品有可能是钠的化合物,需要用焰色反应来进一步验证。上述过程没有用到的科学探究方法是
| A.假设法 | B.观察法 | C.比较法 | D.实验法 |
下列说法正确的是
| A.电极方程式:Cu-2e- = Cu2+,既能发生在原电池中,又能发生在电解池中 |
| B.某温度下,10mL 0.1mol/L的H2SO4溶液与10mL 0.4 mol/L的KOH溶液混合后,pH=13 |
| C.断裂1mol H-H、N-H、N≡N键需吸收的能量分别为a kJ、b kJ、c kJ, 则2NH3( g) 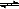 3H2(g)+N2(g) △H="(3a+c-6b)" kJ/mol 3H2(g)+N2(g) △H="(3a+c-6b)" kJ/mol |
| D.中和等体积的醋酸溶液,消耗等pH值的氨水和氢氧化钠溶液的体积分别为V1、V2,则V1<V2 |
对于可逆反应: 下列各图中正确的是
下列各图中正确的是