(15分)
某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下: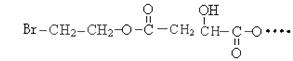
已知加热X与足理的NaOH水溶液反应时,得到A、B、C三种有机物,其中C中含
碳原子最多。室温下A经盐酸酸化可得到苹果酸E,E的结构简式为: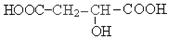
请回答:
(1) B中含有的官能团为 。(填名称)
(2)1molX与足量的NaOH水溶液充分反应,消耗NaOH的物质的量为 。
(3)C经酸化可得到有机物G,G不能发生的反应类型有 (填序号)。
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(4)1 molC酸化后与足量浓溴水充分反应需 mol Br2 。
(5) E在浓H2SO4作用下可生成六元环状化合物,其化学方程式为 。
(6)E的两种同分异构体F、G有如下特点:1molF或G可以和3molNa发生反应,放出标准状况下33.6LH2,1molF或G可以和足量NaHCO3溶液反应,生成1molCO2,1molF或G还可以发生银镜反应,生成2molAg。则F和G的结构简式分别是 、 。
(12分)重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等。以铬铁矿(主要成分为Cr2O3还含有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下: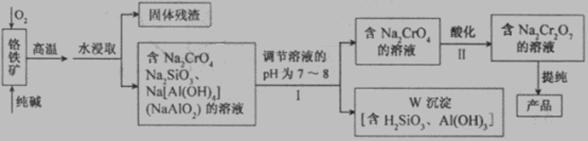 请回答下列问题。
请回答下列问题。
(1)若I中只用一种试剂调节溶液的pH,应选用___________(填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
(2)I中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是
_______________________________________________________ (用离子方程式表示)。
(3)Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下: 2CrO42- (黄色)+2H+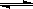 Cr2O72- (橙红色)+H2O
Cr2O72- (橙红色)+H2O
①该反应________氧化还原反应(填“是”或“不是”),反应的平衡常数表达式 K=__________。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液_______ (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃时,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是_____________________。
(12分)Ⅰ、(1)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵,则①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)。
(2)已知某温度下,纯水中的C(H+)=5×10-7mol/L,则此时溶液的C(OH-)为 mol/L;若温度不变,将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=。
Ⅱ、在一个容积固定的密闭容器中,要求通过调节体系的温度使反应A(g)+2B(g) 2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
⑴若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应是热反应。
⑵欲使反应维持向逆反应方向移动,则x的取值范围为。
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12mol),按D(g)+E(g) 2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为(用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为(用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
在537℃、1.01×105 Pa时,往容积可变的密闭容器中充入1 mol X和3 mol Y,此时容积为V L。保持恒温恒压,发生反应X(g)+3Y(g) 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
(1)达到平衡时,X的转化率约为。
(2)保持上述温度和压强恒定不变,若向容器中只充入4 mol Z,则反应达到平衡时,平衡气体中Y 的体积分数为,容器的容积为L。
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2 mol X和6 mol Y反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为。
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105 Pa,若a: b =" 1:" 3,则a =。
已知:HCN的结构为H-C≡N,R-CN RCOOH,R-Cl+CN-→ R-CN+Cl-(R为烃基)。玉米芯.甘蔗渣等废物水解发酵后可制得糠醛
RCOOH,R-Cl+CN-→ R-CN+Cl-(R为烃基)。玉米芯.甘蔗渣等废物水解发酵后可制得糠醛 ,它是重要的化工原料,它在一定条件下可发生以下变化:
,它是重要的化工原料,它在一定条件下可发生以下变化:
(1)写出反应类型:② ,④ 。
(2)写出反应③的化学方程式:;
写出能证明糠醛中含有醛基的一个化学反应方程式
。
(3)若E为环状化合物,则其结构简式。
(4)若E为高聚物,则其结构简式。
已知X和Y各是由两种常见元素组成的化合物,A.B为气体,G为白色沉淀,F是一种两性氢氧化物,在电解开始时,溶液中有白色沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为澄清溶液C(有两种溶质),X.W.C.E的焰色反应均为黄色。各物质之间的关系如图所示(部分产物已经省略,除气体间的反应外,其余反应均在溶液中进行)。
(1)X、Y、W的化学式分别为..
(2)写出反应①的离子方程式
(3)A与B反应生成1 mol D时放出热量为92.3 kJ,则此反应的热化学方程式为。
(4)向澄清溶液C中加入10 mol·L-1的硫酸,当加至50 mL时才开始出现沉淀,假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100 mL,Y溶液的物质的量浓度为a mol·L-1,则X溶液的物质的量浓度为mol·L-1(含a代数式表示)。