已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。
在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,试回答下列问题:
(1)写出a点反应的离子方程式________________;
反应中还原剂是_________;被还原的元素是_________。
(2)写出b点到c点反应的离子方程式___________。
(3)当溶液中的I-为0.4 mol时,加入的KIO3为_____________mol 。
(4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为
____________________________________________________。
Ⅰ.现有CH4、C2H4、苯三种有机化合物:
(1)等质量的以上三种物质完全燃烧时耗去O2的量最多的是_______。
(2)等物质的量以上三种物质完全燃烧时耗去O2的量最多的是________。
(3)等质量的以上三种物质完全燃烧时生成CO2的量最多的是________。
Ⅱ.按要求书写:
(1)羟基的电子式;
(2)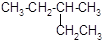 的系统命名为。
的系统命名为。
(3)相对分子质量为72且沸点最低的烷烃的结构简式;
(4)某芳香烃的相对分子质量为102,若该分子内所有原子均在同一平面内,则其结构简式为。
随着经济的不断发展,人们对环境问题也越来越关注。
(1)室内空气污染问题得到越来越多的关注,下列物质中也属于室内挥发性有机污染物的是_____。(填字母)
a.苯b.甲烷 c.醋酸 d.乙烯
(2)下列措施中,有利于降低室内污染物浓度的是__________。(填字母)
a.勤开窗通风
b.日常生活中利用天然气替代煤作燃料
c.使用“绿色环保”装饰材料
d.室内放一些活性碳
(3)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O C6H12O6+6O2
C6H12O6+6O2
b.CO2 + 3H2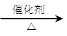 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4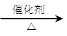 CH3COOH
CH3COOH
d.2CO2 + 6H2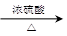 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是,原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)最高的是。
(4)氟氯代烷(商品名氟利昂)曾被广泛用作制冷剂、灭火剂、溶剂等,因氯、溴的氟代烷对____产生破坏作用而被禁止、限制使用。
(5)“汽车尾气污染”已倍受世人关注。以辛烷(C8H18)代表汽油的成分,要使辛烷正好完全燃烧,则辛烷气与空气(空气中O2占1/5体积)的体积比(相同条件下)为(保留三位小数)。
由一溴乙烷制备可制备各种物质,请写出各步反应的化学方程式: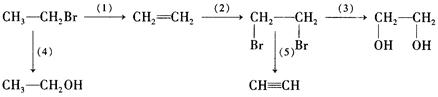
(1)_______________________________________;
(2)______________________________________;
(3)________________________________________。
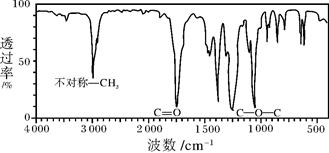
(8分)(1)下图是一种分子式为C4H8O2的有机物的红外光谱图,则该有机物可能的结构简式为
______________________、______________________。
(2)已知1丙醇和2丙醇的结构简式如下:
1丙醇:CH3CH2CH2OH
2丙醇: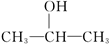
下图是这两种物质中其中一种的核磁共振谱,并且峰面积比分别为1∶1∶6,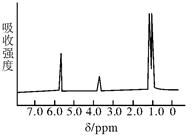
请指出该核磁共振谱表示的物质是____________,
(3)某有机化合物A的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
①该化合物的相对分子质量是________。
②该化合物的化学式是_______________。
(7分)A~G是几种烃的分子球棍模型,据此回答下列问题:
(1)常温下含碳量最高的气态烃是________(填对应字母);
(2)能够发生加成反应的烃有________(填数字)种;
(3)一卤代物种类最多的是________(填对应字母);
(4)写出实验室制取C的化学方程式_______________________________________;
(5)写出F发生溴代反应的化学方程式____________________________________。