以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的是
(填序号),写出反应⑥的化学方程式__ ____。
以下可逆反应中,达到平衡后,通过升高温度可提高反应物转化率的是;通过增大压强可提高反应物转化率的是;改变压强,转化率不变的是。
①A(s)+B(g)  C(g),ΔH < 0;
C(g),ΔH < 0;
②N2(g)+3H2(g)  2NH3(g), ΔH < 0;
2NH3(g), ΔH < 0;
③2NO2(g)  2NO(g) +O2(g),ΔH > 0;
2NO(g) +O2(g),ΔH > 0;
④2SO2(g)+O2(g)  2SO3(g) ,ΔH < 0。
2SO3(g) ,ΔH < 0。
⑤CO(g)+NO2(g)  CO2(g) +NO(g),ΔH < 0;
CO2(g) +NO(g),ΔH < 0;
冶金工业上为降低硫的氧化物对空气的污染,常用CO在500℃、铝矾土催化下还原SO2,处理烟道废弃回收硫,写出该反应的化学方程式。
硫酸工业常用收SO3,是为了避免;在生产过程中为了提高原料的利用率,常用、。
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。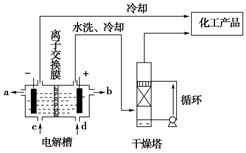
(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是______;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为______________________________________________________。
②SiCl4可转化为SiHCl3而循环使用,一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s)4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为______kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气________m3(标准状况)。
氢氧化钠是一种用途十分广泛的重要化工原料。工业上主要通过电解氯化钠饱和溶液的方法获得氢氧化钠,我国的氯碱工业大多数采用离子交换膜电解槽。
(1)离子交换膜电解槽一般采用金属钛作阳极,其原因是
阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是________________________________________________________________________。
(2)为使电解氯化钠的速率加快,下列措施可行的是________。
a.增大阴极碳钢网的面积
b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离
d.提高电解时电源电压
(3)如果将某离子交换膜电解槽①电解时的电压增大到原来的2倍;②电解时的电流强度增大到原来的2倍;③电解时温度从30 ℃提高到60 ℃,则电解速率一定会达到原来2倍的是________。