【化学—选修3:物质结构与性质】X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的。Z是同周期元素中离子半径最小的元素。W原子的价电子层上有两个运动状态不同的电子。请回答下列问题: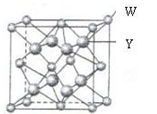
(1)X、Y两种元素的元素符号是: 、 。X、Y可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是: ;中心原子的杂化方式是: 。这种化合物不易作配体形成配离子的原因是 。
(2)X的氢化物易溶于水的原因是: 。
(3)Z的电子排布式是: 。根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Z属于 区。
(4)W与Y形成的化合物的晶胞边长为a pm。晶胞中含有________个W离子、W离子的配位数是 ,晶体的密度是________g·cm-3。(只要求列算式,不必计算出数值,阿伏加德罗常数数值为NA)。
已知下列反应:①2Na+2H2O=2NaOH+H2↑ ②2F2+2H2O=4HF+O2③Cl2+H2O=HCl+HClO
④2NaCl+2H2O通电2NaOH+H2↑+ Cl2↑⑤CaO+H2O=Ca(OH)2⑥CaCO3+H2O+CO2=Ca(HCO3)2
(1)其中水在反应中作氧化剂的反应是(填代号下同) 。
(2)其中水在反应中作还原剂的反应是 。
(3)其中水在反应中既不作氧化剂也不作还原剂的反应是 。
过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法。
已知:温度过高过氧化钙会分解生成氧化物和氧气。
【方法1】由Ca(OH)2为原料最终制得,其制备流程如下: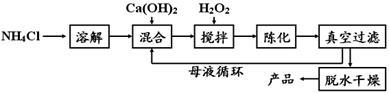
【方法2】由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下:
(1)方法1中搅拌的目的是 ;请将搅拌过程中发生反应的化学方程式补充完整:CaCl2 + H2O2
+ 2NH3·H2O + 6 = CaO2·8H2O↓+ 2NH4Cl;制备过程中除水外可循环使用的物质是 (填化学式)。
(2)方法2中气体X是 ,实验室常用 溶液来检验;煅烧后的反应是化合反应,也能生成CaO2·8H2O,反应的化学方程式为 ;该反应需控制温度在0~ 2℃,可将反应器放置在 中,获得CaO2产品中主要含有的固体杂质是 (填化学式)。
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高除了防止氨水挥发外,还能 。
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2·8H2O的反应符合“绿色化学”的是 (填“方法1”或“方法2”)。
合金是重要的金属材料。
(1)下列物品所使用的主要材料属于合金的是 (填字母序号,下同)。
A.青花瓷瓶 B.橡胶充气艇C.不锈钢锅
(2)生铁是常用的合金,生铁属于 (填“纯净物”或“混合物”)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明 。
(4)黄铜渣中约含 、
、 、
、 、
、 ,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):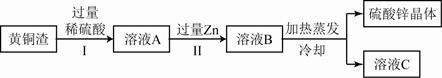
已知: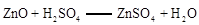 ;
;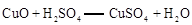
①II中反应的化学方程式为 ;
②下列说法正确的是 。
a.I、II中的操作均包含过滤 b.溶液A中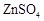 的质量大于
的质量大于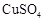
c.溶液A 的质量小于溶液Bd.溶液C中溶质的质量分数小于溶液B
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO‾+H+ΔH>0。
CH3COO‾+H+ΔH>0。
(1)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO‾)=__________;下列方法中,可以使0.10 mol·L‾1CH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol·L‾1的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol·L‾1
e.加入少量氯化钠固体
f.加入少量0.10 mol·L‾1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)______V(醋酸),反应的最初速率为:υ(盐酸)_____υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va____Vb;溶液中各离子的浓度按照由大到小排序为___________。
(4)已知:90℃时,水的离子积常数为Kw = 38×10‾14,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)。
一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A、B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.充入惰性气体(如Ar),平衡向正反应方向移动
D.当2v正(A)=v逆(B)时,反应一定达到平衡状态
(2)K和x的关系满足K=____________。
(3)该反应的逆反应速率与时间的关系如图所示。
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时_________________________;
t8时_________________________。
②t2时平衡向__________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。