有机物X是有机合成工业中一种重要的中间体。X可以由有机物A经过一系列反应制得,也可由另一种有机物Y在一定条件下制得。合成路径如下图所示: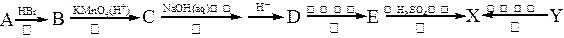 已知:①
已知:①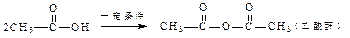
②Y分子中C、H、O(不含其它元素)的个数比为1:1:1,且Y的相对分子质量的范围在80-160之间。
③Y是一种二元酸,且能使Br2/CCl4褪色。
④E和X中都含有五元环。
请回答以下问题:
(1)请指出反应类型:反应②______________,反应⑤_____________。
(2)Y的分子式为_______________;X的结构简式为_______________。
(3)反应①和②的顺序不能调换,请简述理由_________________________________ _。
_。
(4)化合物D在浓H2SO4催化作用下能生成一种高分子化合物,请写出该反应方程式
______________________________________________________。
(5)化合物D有许多同分异构体,其中同分异构体D1和D2都满足以下条件:分子中含有酯基结构,且D1和D2都是二元酸。请写出D1、D2的结构简式:_____________,
_____________。
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为。
(3)验证滤液B含Fe3+,可取少量滤液并加入(填试剂名称)。
(4)滤液E中溶质的主要成份是(填化学式),写出该物质的一种具体用途。
(5)已知298 K时,Mg(OH)2的容度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+) =。
提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空: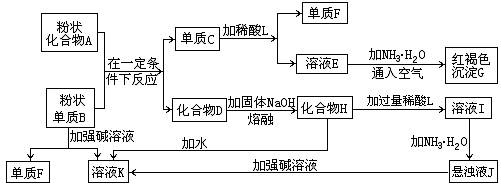
(1)单质F是_____________________。
(2)由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C转化为E、F若改用浓酸,则不能选用的浓酸是(写分子式)______________。
A、C、E是中学化学中常见的单质,A是固体,C、E是无色无味的气体,D是黑色晶体,它们之间的转化关系如下图所示。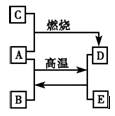
(1)写出A、B、C的化学式:
A___________________;B_________________;C______________。
(2)写出A、B转化为D、E的化学方程式_____________________________________。
(3)写出A与足量稀硝酸反应的离子方程式___________________________________。
若把Fe3O4看成“混合氧化物”时可以写成FeO•Fe2O3,若看成一种盐时又可以写成Fe(FeO2)2。根据化合价规则和这种书写方法,Pb3O4可以分别写作
和。等物质的量的Fe3O4和Pb3O4分别和浓盐酸反应时,所消耗HCl的物质的量相等,不同的是,高价的铅能将HCl氧化而放出氯气。试写出Fe3O4、Pb3O4分别和浓盐酸反应的化学方程式,
。
某无色透明溶液能与铝反应放出H2,该溶液中可能含有:H+、K+、Mg2+、Cl-、OH-、NO3-、CO32-等,试推断:
第一种情况:一定有离子,可能有离子;
第二种情况:一定有离子,可能有离子。