已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)上述反应的化学方程式为 。
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
实验时可观察到装置①中A瓶中的溶液退色,C瓶中的溶液不退色。A瓶中的溶液的作用是
;B瓶中的溶液的作用是 ;C瓶中的溶液的作用是 。
(3)装置②中所加固体药品是无水硫酸铜。可验证的产物是 。
(4)装置③中所盛溶液是澄清石灰水,可验证的产物是 。
实验室需要0.1 mol/L NaOH溶液450 mL。根据这种 溶液的配制情况回答下列问题:
溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。
(2)下列有关容量瓶的说法中,不正确的有 (填序号)。
| A.能配制一定体积准确浓度的标准溶液 | B.可长期贮存溶液 |
| C.能用来加热溶解固体溶质 | D.使用前必须检查是否漏水 |
(3)在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线,则所配制溶液浓度
0.1 mol/L(填“大于”“等于”或“小于”)。
(8分)根据下图提供的仪器装置,完成提纯并测定Na2CO3样品纯度(其中只含NaHCO3杂质)的实验。
| 序号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
| 仪 器 及 装 置 |
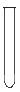 |
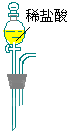 |
 |
 |
 |
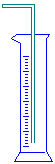 |
 |
请回答下列问题:
实验一:测定Na2 CO3样品中的NaHCO3分解放出的二氧化碳的体积。
CO3样品中的NaHCO3分解放出的二氧化碳的体积。
(1)连接装置的正确顺序是:_________接_________接_________接_________。(写序号)
(2)完成实验一尚缺的仪器是:___________________________。
(3)气体应从装置⑤的_________端进入。(写字母)
实验二:测定经实验一后的固体物质与盐酸反应放出二氧化碳的体积。
(4) 连接装置的正确顺序是:_________接_________接_________接_______(写序号)
(5)当实验一测得产生的二氧化碳为a mol,当实验二测得产生的二氧化碳为b mol。则该样品中碳酸钠纯度的实验值为:______________________。与理论值比较,实验结果_______(填:偏大、偏小或相等);若要使实测值更接近于理论值,该实验应怎样改进?_____(用文字简要说明)
(6分)(1)用18.0 mol/L H2SO4配制100 mL 1.00mol/L H2SO4,则需要的实验仪器除了烧杯、玻璃棒、胶头滴管以外还应该有:______
配制过程中,下列情况会使配制结果偏高的是(填序号)____
①定容是俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
④容量瓶盛过H2SO4溶液,使用前未洗涤
(2)在容量瓶使用方法中,下列操作不正确的是(填字母)_________
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C .配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
D.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转摇匀
用A、B、C三种装置都可制取溴苯。请仔细分析三套装置,然后回答下列问题:
(1)写出三个装置中都发生反应的化学方程式:、 ;写出B的试管中还发生的反应化学方程式;
;写出B的试管中还发生的反应化学方程式;
(2)装置A、C中长导管的作用是;
(3)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反
应开始,对B应进行的操作是,对C应进行的操
作是;
(4)A中存在 加装药品和及时密封的矛盾,因而在实验中
加装药品和及时密封的矛盾,因而在实验中 易造成的不良后果是
易造成的不良后果是
。
某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出)。
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是▲。
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是▲。(填字母)
a.减少副产物烯和醚的生 成 b.减少Br2的生成c.水是反应的催化剂
成 b.减少Br2的生成c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否 含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)。请评价该同学设计的鉴定方案是否合理?为什么?答:▲。
含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)。请评价该同学设计的鉴定方案是否合理?为什么?答:▲。
(4)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| 1-丁醇 |
-89.5 |
117.3 |
1-溴 丁烷 丁烷 |
-112.4 |
101.6 |
| 丁醚 |
-95.3 |
142.4 |
| 1-丁烯 |
-185.3 |
-6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至▲收集所得馏分。