如图转化关系中A—H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)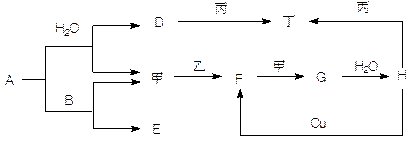
(1)写出下列物质的化学式:A________ F________ 甲_______ 丙________
(2)写出下列反应的化学方程式:A与B ______________________________
Cu与H ________________________________
(3)写出丙与D溶液反应的离子方程式 ________________________________
(4)常温时H的浓溶液与丙物质并不能看到明显的反应现象,原因是
。
A~J分别代表中学化学中常见的一种单质或化合物,其转化关系如图。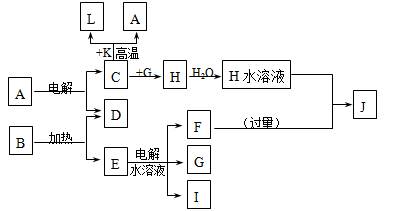
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G 为黄绿色;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃);K为红棕色粉末。
请回答:
(1)I在G中燃烧时的现象为________________________________。
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学方程式_____________________________________。
(3)写出C与K反应的化学方程式______________________,引发该反应的操作为______________________________________________。
(4)J与H反应的离子方程式为_________________________________。若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为_____________。
在 K2Cr2O7 + HCl —— KCl + CrCl3 + Cl2↑+ H2O反应中。
(1)氧化剂是,元素被氧化,氧化产物是。
(2)在参加反应的盐 酸中,被氧化的HCl与未被氧化的HCl的质量比为.
酸中,被氧化的HCl与未被氧化的HCl的质量比为.
(3)如果反应生成0.1molCl2,则转移电子的数目为:
有一瓶溶液只含Cl-、CO32—、SO42—、Na+、NH4+、K+、Mg2+七种离子中的某几种。经实验:
①原溶液 白色沉淀;
白色沉淀; ②将①所得溶液
②将①所得溶液 放出使湿润的红色石蕊试纸变蓝的气体;
放出使湿润的红色石蕊试纸变蓝的气体; ③原溶液
③原溶液 中加BaCl2溶液不产生沉淀。
中加BaCl2溶液不产生沉淀。 ④原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
④原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。 回答下列问题:
回答下列问题: (1) 试分析原溶液中一定含有的离子是,一定不含
(1) 试分析原溶液中一定含有的离子是,一定不含 有的离子是,可能含有的离子是。
有的离子是,可能含有的离子是。 (2) 有同学认为实验④可以省略,你认为呢?(填“可以”或“不可以”),
(2) 有同学认为实验④可以省略,你认为呢?(填“可以”或“不可以”), 并说明理由。
并说明理由。
(
有以下几种物质
| A.氯化钠 | B.硫酸(H2SO4) | C.醋酸(CH3COOH) | D.氯化银 E、酒精 F、蔗糖 |
G、氨气 H、二氧化硫 I、铜 J、硫酸钡 K、硝酸钠溶液 L、氢氧化铜
M、食盐水 N、石墨
请填空回答(填序号)。
(1)以上物质中能导电的是;
(2)以上物质中属于电解质的是;
(3)以上物质中属于非电解质的是;
(4)以上物质中既不属于电解质又不属于非电解质的是.
(每空2分共8分)
向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
N2(g)+ 3 H2(g) 2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
①.若a=0,b=0,则c=
②.若a=0.7,b=2.1,则:
Ⅰ.c=.
Ⅱ.这时反应向进行.
Ⅲ.若要维持反应开始向该反应方向进行,c的范围是