室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在适合的反应条件下,它们可以按照下面框图进行反应。又知E是无色溶液,请回答: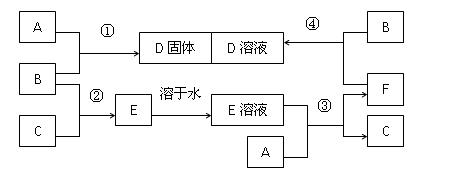
(1)B溶于水的离子方程式  。
。
(2)反应④的离子方程式为 。
(3)向F的溶液中加入烧碱溶液后在空气中静置,可观察到的现象有 。
元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。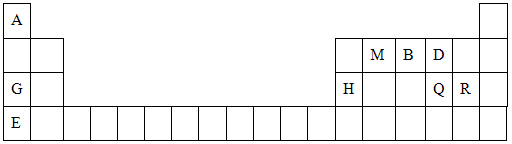
(1)Q元素在元素周期表中的位置,E元素原子结构示意图为_____
(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)_________________________________。
(3)M、D两元素形成的化合物中含有的化学键类型是,其MD2分子的结构式:。
(4)用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:
;元素G、H的金属性强弱:
A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族。用化学符号或化学用语回答下列问题:
(1)用电子式表示下列物质A2C2,DCA_________________;
(2)用电子式表示D与F形成化合物的过程;
(3)用“化学式”和“<或>”比较:A与C、A与F形成化合物的稳定性;沸点的高低 ,沸点高低的原因 ;
(4)写出E与烧碱反应的离子方程式。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是(填名称) ,W在周期表中的位置。
(2)X与Y 形成化合物的电子式为,X与W组成的化合物中存在键(填“离子”“共价”)。
(3)写出实验室制备YX3的化学方程式:
(4)由X、Y、Z、W四种元素组成的一种离子化合物A已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。则A的名称是。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则B的化学式为。
下图中的每一个方格表示有关的一种反应物或生成物,其中X为酸式盐,A是能使澄清石灰水变浑浊的无色无味气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,请回答: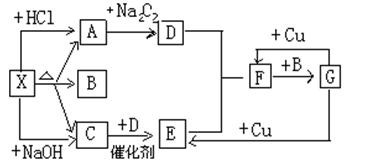
(1)写出A的电子式。干燥C所用药品是。
(2)X形成的化合物为化合物(填“离子”或“共价”);检验X 中阳离子的方
法是
(3)写出反应的化学方程式
C→E:____________________________
F→G:____________________________
(4)X与足量烧碱反应的离子方程式
下图中A~G均为中学化学中常见的物质,它们之间有如下转化关系。其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气,而且D为红棕色。请回答以下问题:
(1)A元素在元素周期表中位于周期族,C的化学式是______________。
(2)写出D与E反应转化为F和B的化学方程式________________________________。
(3)在常温下,B的稀溶液也可与Cu反应生成F。此反应的离子方程式:
。