A、B、C、D、E五种常见物质,均为可溶于水的固体,两种物质的焰色反应为黄色,且二者 的溶液混合会产生无色无味气体。组成它们的离子有
的溶液混合会产生无色无味气体。组成它们的离子有
| 阳离子 |
Na+、Mg2+、Al3+、Ba2+ |
| 阴离子 |
OH-、Cl-、CO32-、SO42-、HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们分别是(写化学式)
A ;B ;C ;D ;E 。
(13分)
聚丙烯酸钠( )是一种强吸水树脂。由某烃A合成聚丙烯酸钠的流程如下:
)是一种强吸水树脂。由某烃A合成聚丙烯酸钠的流程如下: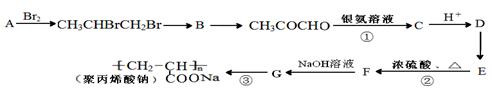
(1)A的名称为,B中官能团的名称是。
(2)物质E的结构简式是。
(3)反应②、③的反应类型分别为、。
(4)反应①发生的化学方程式为。
(5)写出符合下列条件的F的同分异构体(不考虑顺反异构)的结构简式。
a. 链状分子
b. 与新制氢氧化铜在加热条件下反应生成红色沉淀
c. 与NaOH溶液混合后滴入酚酞,加热,溶液颜色变浅
I、为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2。
(1)若有1mol CH4生成,则有molσ键和molπ键断裂。
(2)CH4失去H—(氢负离子)形成CH+3(甲基正离子)。已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为。
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁)。形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18。
(3)金属羰基配合物中,微粒间作用力有(填字母代号)
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃。由此推测,固体羰基铁更接近于(填晶体类型)。若用Fe(CO)x表示羰基铁的化学式,则x=。
III.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释。
答:HgCl42-比HgI42-更(填“稳定”或“不稳定”),因为。
有一瓶澄清的溶液,其中可能含有NH4+、 K+、 Na+、 Mg2+、 Ba2+、 Al3+、
Fe3+、Cl-、Ⅰ-、 NO3-、CO32 -、SO42-中的几种,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈强酸性;
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色;
(3)另取出部分溶液,逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生;
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成;。
(5)根据以上实验事实确定①该溶液肯定存在的离子是;②肯定不存在的离子是_____________________________;③还不能确定的离子是________________________,要确定其中的阳离子可利用的方法原理是________________
(1)硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水,其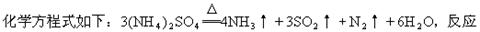
成的氧化产物与还原产物分子个数之比为_______________。
(2)某钠盐A的溶液,实验时有以下一现象:(1)加入Ba(NO3)2溶液时出现白色沉淀,(2)加入Na2CO3,有气泡产生,由此可判断出该钠盐A为___________(化学式),写出有关离子方程式_____________________________,____________________________________。
在酸性条件下:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原成Br2;
②KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原成I2。
(1)上述反应所涉及到的粒子氧化性最强的是(填离子符号);
(2)写出一个能证明氧化性Br2>I2的离子方程式;
(3)向含有KI、H2SO4的溶液中加入KBrO3溶液,若氧化产物、还原产物只有I2和Br2,写出反应的化学方程式,并标明电子转移方向和数目。
_______________________________________________________;
其中被氧化的元素是_________,要得到1mol还原产物转移电子数目为____________。