蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下: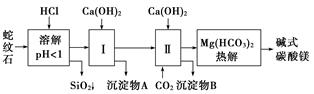
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__________________。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)。
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
1.5 |
3.3 |
9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_____________________ ___________________________________________________(填入物质的化学式),
然后______________________________________________________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③________________________________________________________________________
④________________________________________________________________________
⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:
a=________,b=________,c=________。
下列物质中属于电解质的是,能导电的是,非电解质是。(均填编号)
⑴CuSO4溶液⑵BaSO4固体⑶Cu⑷SO3
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g) ΔH="+131.3" kJ•mol-1,ΔS=+133.7J•(K•mol) -1
CO(g)+H2(g) ΔH="+131.3" kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,
下列能判断该反应达到化学平衡状态的是(填字母,下同)
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 molH—O键
c.υ正(CO) =υ逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数
CO2(g)+H2(g),得到如下三组数
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以υ(CO2) 表示的反应速率为。
②该反应的逆反应为 (填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
化学电源在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是(填序号)
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是(填序号)
①以上反应不是可逆反应
②电解质溶液为硫酸
③充电时化学能转变为电能
④放电时镉(Cd)为负极,发生还原反应
⑤放电时正极区pH升高
(2)氢氧燃料电池突出优点是把化学能直接转化为电能,而不经过热能中间形成,发生的反应为: 则负极反应式为____________。一段时间后,KOH溶液的浓度(“变大”、“变小”或“不变”)
则负极反应式为____________。一段时间后,KOH溶液的浓度(“变大”、“变小”或“不变”)
(3)在用惰性电极电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,下列物质中不能选用的是(填序号)
| A.NaOH | B.H2SO4 | C.Na2SO4 | D.CuSO4 |
按下图装置进行实验,并回答下列问题:
(1)判断装置的名称:A池为B池为
(2)铜极的电极反应式为石墨棒C2附近发生的实验现象为
(3)当C2极析出224mL气体(标准状况)时,锌的质量减少g。
在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g)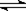 SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
(1)该温度下的该反应的平衡常数=__________________(用数值表示)
(2)该温度下、该容器中,再继续加入1mol的SO2(g),则:
①化学平衡将向________方向移动,NO2的转化率将____________;
②经计算,当达到新的平衡状态时,容器中SO2(g)的浓度是_______mol/L;