按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为
(2)锌电极反应式为__________________
石墨棒C1为______极,电极反应式为__________
石墨棒C2附近发生的实验现象为______________
(3)当C2极析出2.24L气体(标准状态)时,锌的质量减少了__g.CuSO4溶液的质量增加了______g
有机物X、Y、Z都是芳香族化合物, X与Z互为同分异构体,Y的分子式为C9H8O,试回答下列问题。
(1)X是一种重要的医药中间体,结构简式为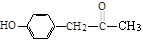 ,X可能发生
,X可能发生
的反应有___________________。
a.取代反应 b.消去反应 c.氧化反应 d.水解反应
(2)有机物Y有如下转化关系: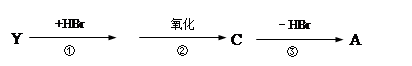
其中Y不能跟金属钠反应;A能跟NaHCO3溶液反应,能使溴的四氯化碳溶液褪色,且苯环上只有一个取代基。
Y的结构简式为______________________或_________________________。
(3)Z可由A经一步反应制得。
① Z的结构简式为______________________或_________________________;
② Z有多种同分异构体,其中属于饱和脂肪酸的酯类,且苯环上只有一个侧链
的同分异构体有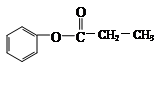 、__________________________、
、__________________________、
_________________________________、_____________________________。
(1)题每空1分,其余每空2分,共12分)物质A是化合物,B、C、D、K都是单质,反应②~⑤都是常见的工业生产的反应,各有关物质之间的相互反应转化关系如下图所示: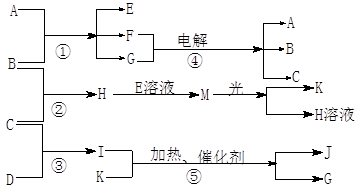
请填写下列空白:
(1)写出下列物质的化学式:B ; C; D;
K;G;J。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
。
(每空2分,共14分)A、B、C、D、E、F六种中学化学中常见的物质,有如图转化关系,则: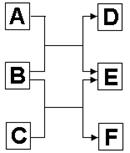
(1)若A、C、E皆为氧化物,且E为有毒气体,B、D、F皆为非金属单质,且D为气体。则A的结构简式为,单质F的晶体类型为,1molC中含有个共价键。
(2)若A、C、E皆为氢化物,三者皆为极性分子,其中C的相对分子质量最小;D、E、F皆为氧化物,其中D、F为有毒气体,F遇空气变为红棕色则。
①A、C、E沸点由高到低的顺序为,(填化学式);A、C、E三种气态氢化物稳定性最强的是(填化学式)。
②B跟C反应生成E和F的化学方程式为。
③A跟D常温下反应可生成一种单质,化学方程式为。
((2)题每空3分,其余每空2分,共12分)A、B、C、D均为中学化学常见的物质,它们之间的反应关系如下图:
回答下列问题:
(1)若A是可溶性的强碱,B是酸式盐,D不溶于稀硝酸,则B的化学式为________________,有关的离子方程式为___________________________________。
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。
①若C为能使澄清石灰水变浑浊的无色无味气体,该反应的离子方程式为
____________________________________________________。
②若A是一种淡黄色固体,且A与B以物质的量之比3∶1混合时,推知B的化学式为
__________。
(3)若B为Ca(HCO3)2溶液,A与B的溶液反应时只生成气体C、CaCO3和水,则A的化学式为__________________。
(每空2分,共16分)短周期元素X、Y、Z、W,原子序数依次增大。常温常压下,只有W的单质为气体。它们的最高氧化物对应的水化物依次为甲、乙、丙、丁。甲、乙、丙是中学化学中的常见物质,其中只有乙难溶于水,且能和甲、丙反应得到澄清溶液。根据以上信息填写下列空白:
⑴画出W的原子结构示意图_________________________________________;
⑵将乙和甲、丙分别反应后得到的溶液混合,观察到的现象是___________________
___________________,两溶液混合时所发生反应的离子方程式为____________________________________________________;
⑶下列事实能证明Z和W非金属性强弱的是(选填序号)__________________________;
| A.单质的熔点:Z>W2 |
| B.酸性:丁>丙 |
| C.在溶液中:W2+H2Z=2HW+Z |
| D.稳定性:HW>H2Z |
E.氢化物水溶液的酸性:HW>H2Z
F.溶解性:丁>丙
⑷用Y单质和生活中最常用的金属作电极,用导线连接插入甲的溶液中构成原电池,该原电池负极的电极反应式为_______________________________________________;
⑸工业上以XW为原料可以进行许多化生产,甲和W2都是其主要产品。写出工业上以XW为原料生产甲和W2的化学方程式_______________________________________________
_______________________________________________;若要生产80.0 kg甲物质,至少需要XW______________kg,同时可得W2_____________m3(标况)。