氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水同时得到两种气体(气体A是所有气体中密度最小的气体,气体B是制取漂白粉的原料)和一种易溶、易电离的碱。
(1)试写出电解食盐水的化学方程式 (注明反应条件)。
(2)试写出气体B与澄清石灰水反应的离子方程式 。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题: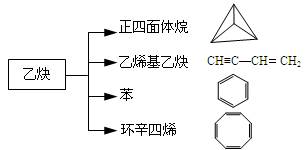
(1)正四面体烷的二氯取代产物有种。
(2)关于乙烯基乙炔分子的说法错误的是
a、能使酸性高锰酸钾溶液褪色
b、1mol乙烯基乙炔能与3mol Br2发生加成反应
c、乙烯基乙炔分子内含有两种官能团
d、等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):、。
生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。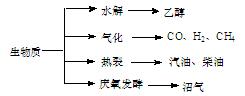
(1)下列有关说法正确的是。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应: CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
| 平衡常数 |
K1 |
K2 |
K3 |
| 反应物转化率 |
α1 |
α 2 |
α3 |
下列说法正确的是。
a. c1=c2 b. 2Q1=Q3 c. K1=K3 d. α2+ α3<100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g)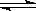 CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)=mol。
②下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。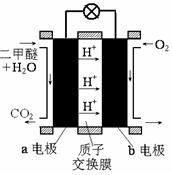
b电极是极;a电极的反应式为。
( 12分)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。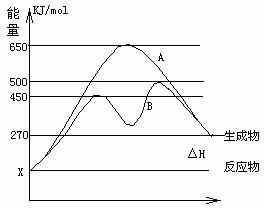
(1)据图判断该反应是___①___(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__②__ (填“增大”、“减小”或“不变”)
(2)其中B历程表明此反应采用的条件为___③___ (选填下列序号字母),作出正确的判断的理由为__④____
A、升高温度 B、增大反应物的浓度C、降低温度 D、使用了催化剂
(3)若△H的数值为200KJ/mol,则此反应在A反应历程中的正反应的
活化能为___⑤___KJ/mol,x值应为 ___⑥___KJ/mol.
塑料制品是商业流通中的重要组分,人们会经常遇到以英文缩写的多种产品,例如:
①PVC-聚氯乙烯,②PS-聚苯乙烯,③ABS-工程塑料,其结构简式为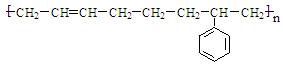
合成这些塑料的反应都属于______________反应。
请写出它们合成的化学方程式:
(1)合成PVC:
_________________________________________________________________
(2)合成ABS:
_________________________________________________________________
我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。PETG的结构简式如下: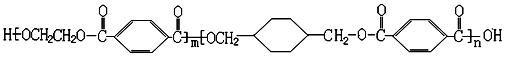
这种材料可采用如下图所示的合成路线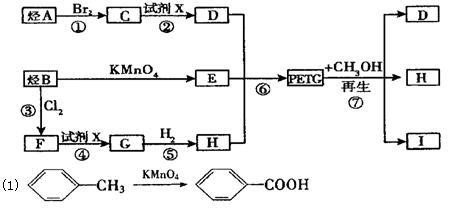
(2)RCOORl+R2OH→RCOOR2+R1OH(R、R1、R2表示烃基)
试回答下列问题:
(1) ③的反应类型是 。
③的反应类型是 。
(2)写出I的结构简式: 。
(3)合成时应控制的单体的物质的量:n(H):n(E):n (D)=(用m、n表示)。
(4)写出反应②的化学方程式:
(5)写出同时符合下列两项要求的E的所有同分异构体的结构简式。
①该同分异构体的苯环上相邻的三个碳原子上都连有取代基。
②该同分异构体在一定条件下能发生银镜反应和水解反应,遇到FeCl3溶液显紫色。
、 、 。