在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g)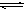 aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;
平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是__________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为__________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?__________,其理由是____________________。
(4)维持温度、体积不变,若起始时向容器中加入的物质的量如下列各项,反应达到平衡后放出的热量仍为Q1 kJ的是__________(稀有气体不参与反应)。
| A.2 mol X、1 mol Y、1 mol Ar | B.a mol Z、1 mol W |
| C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W | D.2 mol X、1 mol Y、1 mol Z |
含氮化合物对人类生活有十分重大的意义。
(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合。
已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+ O2(g)=2H2O(g) △H=-483.6kJ/mol
①写出工业合成氨的热化学方程式:。
②实验室模拟合成氨,在2L密闭容器中投入1molN2和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为;达平衡时,N2的转化率为。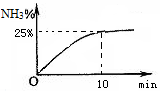
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,再达平衡时,N2的体积分数将,平衡常数(填“增大”“减小”或“不变”)
(2)科学家一直致力于研究常温常压下“人工固氮”的方法。据报道:在常温常压条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水反应,生成NH3和一种单质。进一步研究NH3生成量与温度关系,部分实验数据如下(反应时间3h,其余条件一样)
| T/℃ |
30 |
40 |
50 |
| NH3生成量/10-6mol |
4.8 |
5.9 |
6.0 |
①写出常温下“人工固氮”反应的化学方程式:_此反应△H0(填“>”、“<”或“=)。
②该反应中的催化剂TiO2的制取方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。写出TiCl4水解的化学方程式:。
③在上述固氮过程中,除加入催化剂外,能提高生产速率,但不降低产率的措施还可以是。
A.适当升高温度 B.将氨气液化分离
C.增大反应物N2的浓度 D.增大压强
查文献知,CH3COOH、H3PO3(二元酸)、H3PO4三种酸所有的逐级电离常数如下:
| 酸 |
电离常数(Ka) |
酸 |
电离常数(Ka) |
| CH3COOH |
1.8×10-5 |
H3PO4 |
K1=7.1×10-3 |
| H3PO3 |
K1=3.7×10-2 |
K2=6.2×10-8 |
|
| K2 =2.9×10-7 |
K3=4.5×10-13 |
用化学用语回答下列问题:
(1)上述三种酸中,酸性最强的是;
(2)常温下,在NaH2PO3稀溶液中:c(H3PO3) < c(HPO32-),则该溶液pH_______7;(填“>”“<”或“=”)
(3)等温度、等浓度的NaH2PO4溶液与Na2HPO4溶液比较,c(H3PO4)较大的是:_____;
(4)25℃时,浓度均为0.01 mol/L 的CH3COONa、Na2HPO3、Na3PO4溶液,pH最大的是:_________________;
(5)在NaH2PO3溶液中,粒子间存在等量关系:c(H3PO3)+_____________= c(Na+)。(用溶液中其它粒子浓度补充完整)
如图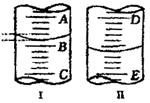
(1)图I表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是mL。
(2)图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)。
A.是a mLB.是(25-a)mL
C.一定大于a mLD.一定大于(25-a)mL
(3)写出下列物质的水解离子方程式NaClO溶液:Fe2 (SO4)3 溶液
有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)试推断它们各是什么元素,写出它们的元素符号:
A______、B______、C______、D______、E 、
(2)写出A、C、D形成的化合物与A、D、E形成的化合物反应的化学方程式:
下图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置。
试回答:
(1)C、D、G三个装置所盛放的试剂分别是:
C_____________________________________________________
D___________
G
(2)F中的现象为___________________________,生成物是________。
(3)写出在A、E、G中发生反应的化学方程式为:
A:;
E:;
G: