(8分)有机物A与乙酸无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,回答:
⑴满足题干条件的A应与乙酸具有相同的___________________。
(2) 若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
(3)若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
(4)若A分子中氧元素质量分数为13.33%,其余为C、H且其原子个数比为1:1,,且A的相对分子质量小于200,则A的分子式为___________。
为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中。
供选择的化学试剂:
| A.酸性高锰酸钾溶液 | B.硝酸银溶液和硝酸 | C.氢氧化钠溶液 | D.氧化钙 |

A、B、C、D、E、F六种物质在一定条件下有下图所示的相互转化关系,所有反应物和生成物均已给出。试回答: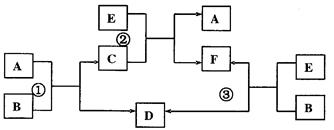
(1)若反应①、②、③均为溶液中进行的置换反应,A、D、E分别为铝、铁、铜三种金属中的一种,则A的元素符号为____________。请写出反应③的离子方程式:
________________________________________________________________。
(2)反应①、②、③均为在溶液中进行的复分解反应。A在常温下为无色刺激性气体,并能使湿润的红色石蕊试纸变蓝;E为常见碱,其焰色反应呈黄色;溶液中形成的D是白色沉淀,且具有两性。
若B能与硝酸银溶液反应产生白色沉淀,则B的化学式为____________________。
写出E与D反应的离子方程式____________________________________________。
(1)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,请用化学方程式 表示该反应的原理:。
表示该反应的原理:。
(2)炒菜时,经常加入少量的料酒(含乙醇)和醋,可使菜变得香醇可口,主要是因为上述两种物质发生了某种反应,请用化学方程式表示该反应的原理:
。
(3 )醋还可用于除去热水瓶胆内的水垢(设其主要成分为碳酸钙),请用化学方程式表示该反应的原理:。
)醋还可用于除去热水瓶胆内的水垢(设其主要成分为碳酸钙),请用化学方程式表示该反应的原理:。
(4 分)
分)
(1)药物黄麻碱是从中药麻黄中提取的生物碱,可用于治疗支气管哮喘、鼻黏膜充血引起
的鼻塞等。服用麻黄碱的不良反应是有时会出现由于中枢兴奋所导致的不安、失眠等,
晚间服用最好同服镇静催眠药以防止失眠。麻黄碱的结构简式如图所示。
请写出麻黄碱的分子式__________________
(2)药物可分为处方药和非处方药。“OTC”表示____________________
从
| A.甲醛 | B.葡萄糖 | C.乙醇 | D.油脂等四种有机物中选择合适的答案,将其标号填在空格内。 |
(1)工业上制备肥皂的主要原料是 。
。
(2)家居装修材料中散发出的有毒物质是
(3)常用做燃料和医药上消毒剂的是
(4)糖尿病人通常是指病人的尿液中的含量高。