某同学利用铁与水蒸气反应后的固体物质进行了如下实验: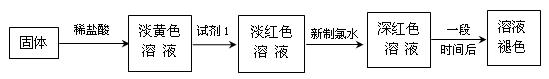
(1)固体溶于稀盐酸的化学方程式为 ;
(2)试剂1的化学式是 ;加入试剂1后呈红色的原因是(用离子方程式表示): 。
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示) ;
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?
| 编 号 |
猜 想 |
| 甲 |
溶液中的+3价Fe又被还原为+2价Fe |
| 乙 |
溶液中的SCN-被过量的氯水氧化 |
| 丙 |
新制的氯水具有漂白性,将该溶液漂白 |
| 丁 |
? |
为验证乙同学的猜想合理与否?请同学们根据结论完成下表的实验设计方案。可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0 mol·L-1 NaOH、0.1mol·L-1FeCl3、0.1mol·L-1CuSO4、20%KSCN、蒸馏水。
| 实验操作 |
预期现象 |
结 论 |
| |
|
说明乙同学的猜想是合理的 |
根据下列叙述,画出对应1--3的微粒结 构示意图:
构示意图:
(1)A元素原子的最外层电子数为电子层数的3倍:。
(2)与Ar原子电子层结构相同的-1价阴离子:。
(3)质量数为23,中子数为12的原子。
(4)写出下列物质的名称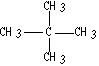 ___________
___________
(5)C5H12的同分异构体有种
(8分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是;
②生成固体C的化学方程式是。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①A的化学式是;
②向苛性钠溶液中通入过量的B,所发生反应的离子方程式是;
已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。

(1)写出下列物质的化学式;乙;B 。
。
(2)写出3反应的化学方程式。
(3)写出2反应的离子方程式:。
Ⅰ、除去下列物质中所混有的少量杂质,写出有关的反应方程式。
(1)铜粉中混有少量铝粉;
(2) FeCl3中混有少量FeCl2;
(3)Na2CO3固体中混有少量NaHCO3。
Ⅱ、氯气溶于水发生反应,写出其化学方程式。某学生为了探究氯水的成分,请你与他一起完成探究过 程,并书写实验报告。
程,并书写实验报告。
| 实验步骤 |
操作方法 |
实验现象 |
结论或解释 |
| 1 |
观察氯水的颜色 |
含有Cl2 |
|
| 2 |
有无色气体产生 |
含有H+ |
|
| 3 |
取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液 |
有白色沉淀生成 |
|
| 4 |
取少量氯水于试管中,放入红色布条 |
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。
在每次实验时,记录图中电压表指针的移动方向和电压表的读数如下:
| 金属 |
电子流动方向 |
电压/V |
| A |
A→Cu |
+0.78 |
| B |
Cu→B |
-0.15 |
| C |
C→Cu |
+1.35 |
| D |
D→Cu |
+0.30 |
已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
请根据表中数据回答下列问题。
(1)__________金属可能是最强的还原剂;_______金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润, 则在滤纸上能看到有蓝色沉淀析出的金属是__________(填字母)。其对应电池的电极反应式为:
则在滤纸上能看到有蓝色沉淀析出的金属是__________(填字母)。其对应电池的电极反应式为:
负极: _______________________;正极: ________________________。