X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。请推断后回答下列问题:
(1)写出:W的原子结构示意图 ,R离子的电子式 ,
Y在周期表中的位置 。
(2)X、Y、Z三种元素形成的化合物属于 化合物(填“离子”或“共价”),其电子式为  。
。
(3)Z在Y单质中燃烧的产物电子式为 ,其中含有的化学键类型为 。
(4)Y、Z、W、R形成的简单离子半径由大到小顺序为 。
(5)W单质与Z的高价氧化物对应的水化物反应的离子方程式为 。
由稀有气体元素Xe(氙)形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入30 mL Mn2+浓度为0.1 mol·L-1的水溶液中,刚好完全反应,放出的唯一气体是Xe单质,其在标准状况下的体积为56 mL,在反应过程中溶液的pH不断减小。
(1)已知Mn2+在不同条件下,可被氧化为+4、+6、+7等不同价态,依据题目所给出的数据推算氧化产物中锰元素的化合价为____________。
(2)试写出有关的离子方程式:________________。
(3)若将反应后的溶液稀释至90 mL,则稀释后溶液的pH为____________。
某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中,H2O2只发生如下过程:H2O2―→O2。
(1)该反应的还原剂是____________。
(2)若反应转移了0.3 mol电子,则产生的气体在标准状况下的体积是______L。
(3)写出该反应的化学方程式:______________________。
2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Cu2+、Al3+ |
| 阴离子 |
SO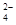 、HCO 、HCO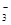 、NO 、NO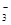 、OH- 、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出化学式:A、B________、C、D________.
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为________.
(3)写出实验②发生反应的离子方程式______________________________________、
________________________________________________________________________.
(4)C常用作净水剂,用离子方程式表示其净水原理______________________________.
(有机化学基础)蜂胶是一种天然抗癌药
物,一个五六万只的蜂群一年只能产100多克蜂胶,所
以蜂胶又被誉为“紫色黄金”。蜂胶的主要活性成分为
咖啡酸苯乙酯,其分子结构如下图所示(短线表示化学
键,如单键、双键等),在一定条件下能发生如下转化: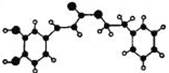

请回答下列问题:
(1)咖啡酸苯乙酯的分子式为,C结构简式为。
(2)① A中含氧官能团的名称为、。
② A 可以发生的反应是(填字母)
a 加成反应 b 酯化反应 c 消去反应 d 氧化反应
③ A 与甲醇反应生成B的化学方程式是。
(3)高分子E的结构简式是。
(4)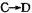 发生反应的反应类型是。
发生反应的反应类型是。
(5)B的同分异构体有很多种,其中同时符合下列条件的同分异构体的结构简式为。
a 苯环上只有两个取代基 b 能发生银镜反应 c 能与氢氧化钠溶液反应
d 不能与氯化铁溶液发生显色反应 e 核磁共振氢谱图中有三组峰
(物质结构与性质)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为:。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C(填“>”或“<”,下同)B;第一电离能:NO 。
(3)月球岩石——玄武岩的主要成分为钛硫酸亚铁 与80%的硫酸反应可生成
与80%的硫酸反应可生成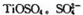 的空间构型为形,其中硫原子采用杂化。
的空间构型为形,其中硫原子采用杂化。
(4)磷酸肽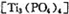 锂离子电池能来那个密度大、安全性高。
锂离子电池能来那个密度大、安全性高。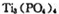 可由
可由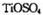 与
与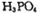 反应制得。两分子
反应制得。两分子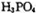 发生脱水生成焦磷酸:
发生脱水生成焦磷酸: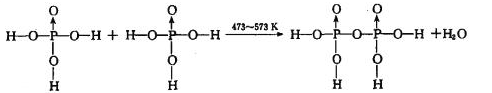
则三分子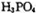 脱去两分子
脱去两分子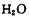 生成三磷酸,其结构式为,四分子
生成三磷酸,其结构式为,四分子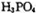 脱去四分子
脱去四分子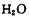 生成的四偏磷酸属于元酸。
生成的四偏磷酸属于元酸。
(5)Ti的氧化物和CaO相互作用能形成太酸盐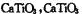 的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围个O2-紧邻。
的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围个O2-紧邻。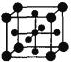
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中
实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重
大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为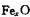 (x<1),若测得某
(x<1),若测得某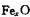 晶体密度为5.71g·cm-3,晶胞边长为4.28×
晶体密度为5.71g·cm-3,晶胞边长为4.28× m,则
m,则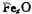 中x=。
中x=。