X、Y、Z和R为原子序数依次递增的四种元素。其中X、Y同周期,X的最高正价是最低负价绝对值的3倍,Y、Z、R同主族,R为人体所需的微量元素。下列说法不正确的是( )
| A.127R—的核外含有54个电子 |
| B.Y、Z、R的氢化物对应酸的酸性逐渐增强 |
| C.有l molY的单质与水发生反应则转移电子的物质的量为2 mol |
| D.在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色 |
化学反应前后肯定没有变化的是()
①原子数目 ②分子数目 ③元素种类 ④物质的总质量 ⑤物质的种类
| A.①③④ | B.①③⑤ | C.③④⑤ | D.①②③④ |
某溶液中含有Ag+、Ba2+、Mg2+离子,为了将这三种离子逐个沉淀分离,加入下列离子的先后顺序正确的是()
| A.CO32-、 Cl-、OH- |
| B.Cl-、CO32-、OH- |
| C.OH-、Cl-、 CO32- |
| D.Cl-、OH-、CO32- |
在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、 Cl-、CO32-、OH-6种离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
| A.Cu2+、H+、Cl- |
| B.CO32-、OH-、Cl- |
| C.K+、H+、Cl- |
| D.K+、OH-、CO32- |
下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是()
A.MnO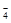 ,K+,Na+,SO ,K+,Na+,SO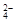 |
B.Na+,K+,HCO ,Cl- ,Cl- |
C.Mg2+,NH ,Cl-,NO ,Cl-,NO |
D.Ba2+,K+,S2-,SO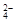 |
能用H+ + OH- = H2O表示的是()
| A.Ba(OH)2溶液和稀H2SO4的反应 |
| B.Cu(OH)2和稀H2SO4的反应 |
| C.NaOH溶液和氢溴酸反应 |
| D.NaOH溶液和醋酸溶液的反应 |