(1)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。目前中学课本中的酸碱理论是1889年阿仑尼乌斯(Arrhenius)提出的电离理论。
①1905年富兰克林(FranKlin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能电离而产生溶剂正离子的物质为酸,凡能电离而产生溶剂负离子的物质为碱。试写出液氨自身电离的方程式: 。
②1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowey)提出质子理论。凡是能够释放质子(氢离子)任何含氢原子的分子或离子都是酸;凡是能够与质子(氢离子)结合的分子或离子都是碱。
按质子理论:下列粒子在水溶液既可以看作酸又可看碱的是 。
A、H2O B、NH4+ C、OH- D、HCO3- E、CH3COO- F、Cl-
③1923年路易斯(Lewis)提出广义的酸碱概念。凡是能给出电子对而形成化学键的物质都是碱;凡是能够和电子对结合的物质都是酸。
酸(电子对接受体)+碱(电子对给予体)→反应产物,如:H++OH-→H2O。
试指出下列两个反应中的酸或碱:
(Ⅰ)H3BO3 +H2O  H++B(OH)4-,该反应中的碱是 (填H3BO3或H2O);
H++B(OH)4-,该反应中的碱是 (填H3BO3或H2O);
(Ⅱ)NaH+H2O ==NaOH+H2↑,该反应中的酸是 (填NaH 或H2O)。
(2)已知A元素原子的K、L层电子数之和比M、L层电子数之和多一个电子;B元素原子核外电子占有9个轨道,且有1个未成对电子;C元素原子核外3p亚层中3个轨道还需5个电子才能达到全充满。D元素只有两个电子层,且最高化合价与最低化合价的代数和为零;E原子半径最小;F元素最外层电子排布为nSnnPn+1。按要求填写
① B的电子排布式是: ,A、B两元素形成的化合物的晶体类型是 。
②D元素单质的晶体类型是 ,C单质的制备方法是: 。
③E和F形成的化合物空间构型为 ,该物质比D与E形成的化合物更容易液化的原因是 。
下图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1。B为常见液体。
试回答下列问题:
(1)X是; F是(都填化学式)。
(2)C E反应的化学方程式。
E反应的化学方程式。
(3)G与Cu的反应中,G表现得性质有。
(4)X与过量NaOH溶液反应(加热)的离子方程式:。
(5)C与G的反应产物的阳离子的检验方法。
(6)以C、B、D为原料可生产G,若使a mol C 完全转化为G,理论上至少需要Dmol。
关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
①上述反应中的氧化剂为。
②上述反应中若生成标况下3.36LN2,则转移的电子数为。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上制取氯气的化学反应方程式为。
②漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,反应的离子方程式为。
(方程式每空2分,其余每空1分,共20分。)氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O =" 2NaOH" + H2↑②2Na2O2 + 2H2O =" 4NaOH" + O2↑
③Na2O+ H2O =2NaOH④3Fe+4H2O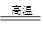 Fe3O4+4H2
Fe3O4+4H2
⑤2H2O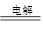 2H2↑+ O2↑⑥2F2 + 2H2O =" 4HF" + O2
2H2↑+ O2↑⑥2F2 + 2H2O =" 4HF" + O2
(1)其中不属于氧化还原反应的是(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是(填编号)
水只作还原剂的反应是(填编号)
水既作氧化剂,又作还原剂是(填编号)
水既不作氧化剂,又不作还原剂是(填编号)
(3)根据你的理解,氧化还原反应的实质是()
| A.分子中的原子重新组合 | B.氧元素的得失 |
| C.电子的得失或共用电子对的偏移 | D.化合价的改变 |
(4)请你运用所学知识分析3NO2+H2O = 2HNO3+NO是否属于氧化还原反应?(填“是”或“不是”),若是,这个反应的氧化剂和还原剂的质量比是。
(Ⅱ)写出下列反应的离子方程式:
①铜片与稀硝酸的反应:
②过量二氧化碳通入澄清石灰水:
③往氯化铝溶液中加入过量的NaOH溶液:
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:
②制漂白液的反应:
③雕刻花玻璃的反应:
(10分)某化学兴趣小组进行如下图所示的电化学实验,实验前查资料获知:铁氰化钾
(K3[Fe(CN)6])遇Fe2+产生 蓝色沉淀。V形管以多孔Pt为电极;U形管A端滴入1~2滴K3[Fe(CN)6]溶液。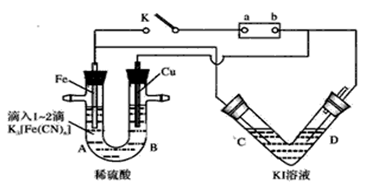
(1)开始时,接通K电键:U形管中无沉淀,可知电源正极为(填“a”或“b”).Fe电极上发生的电极反应为。
(2)断开K电键,V形管中为将能转化为能的装置;U形管A端现象为。
W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W,X,Y,Z。
(2)XW4分子中,中心原子属于杂化,分子的空间构型为;
根据电子云重叠方式的不同,分子里共价键的主要类型为。
(3)写出Y原子价层电子的排布图
(4)X的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为。