纯碱(Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
【实验室制备纯碱】
(1)将饱和NaCl溶液倒入烧杯中加热,控制温度为30—35℃
(2)搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟
(3)静置、过滤得NaHCO3晶体
(4)用少量蒸馏水洗涤、抽干
(5)将所得固体转入蒸发皿中灼烧得Na2CO3固体
问题:
①反应将温度需控制在30—35℃,通常采取的加热方法为 ;控制该温度的原因是 ;
②静置后只析出NaHCO3晶体的原因是 。
【工业制备纯碱】
③沉淀池中反应的离子方程式为 ;
④循环(I)、 循环(Ⅱ)中物质的化学式分别为 。
两种制备纯碱的方法中,共同涉及的化学反应方程式为 。
(1)常温下将0.2 mol•L-1 HCl溶液与0.2 mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2 mol•L-1HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②混合溶液中c(Cl-)-c(M+)= mol•L-1。(填精确计算结果)
(2)常温下若将0.2 mol•L-1 MOH溶液与0.1 mol•L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,若溶液的pH不等于7,则混合溶液的pH 。(填“>7”、“<7”、或“无法确定”)
(4)用0.1000 mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 |
0.1000 mol•L-1 HCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
20.00 |
| 2 |
25.53 |
20.00 |
| 3 |
27.85 |
20.00 |
①待测NaOH溶液的物质的量浓度为 mol•L-1。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是 。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.到达滴定终点时,仰视读数
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
已知N2(g)+3H2(g)⇌2NH3(g);△H=﹣Q1 kJ·mol-1(Q1>0),在一个有催化剂的固定容积的容器中加入1molN2和3molH2,在500℃时充分反应,达平衡后NH3的浓度为w mol•L﹣1,放出热量为Q2 kJ.
(1)达到平衡时,N2的转化率为 ;若此时向原容器中通入少量的氩气,N2的转化率将 (填“增大”、“减小”或“不变”)
(2)若在原来的容器中,只加入2mol NH3,500℃时充分反应达平衡后,吸收热量Q3 kJ,则NH3浓度 (填>、=、<)w mol•L﹣1,Q1、Q2、Q3之间满足何种关系 。
(3)下列措施可以同时提高反应速率和H2的转化率是(填选项序号) .
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3d.升高温度
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入1molN2和3 molH2,500℃时充分反应达平衡后,放出热量Q4kJ,则Q2 Q4(填“>”、“<”或“=”).
已知25℃时有关弱电解质的电离平衡常数如下表:
| 弱电解质化学式 |
CH3COOH |
HCN |
H2CO3 |
NH3.H2O |
| 电离平衡常数 |
1.8×l0–5 |
4.9×l0–10 |
K1=4.3×l0–7 K2=5.6×l0–11 |
1.8×l0–5 |
根据上表中数据回答下列问题:
(1)CH3COO-、CN-、CO32-结合质子(即H+)的能力大小顺序__________________;25℃时,有等浓度的①CH3COONa溶液、②NaCN溶液、③NaHCO3溶液,三种溶液的pH由大到小的顺序为 (填序号)。
(2)NaCN溶液中通入少量二氧化碳,反应的离子方程式为
(3)向稀氨水中加入等体积等浓度的醋酸溶液,则反应后溶液中各离子浓度大小关系为
(4)甲、乙两瓶氨水的浓度分别为1mol·L-1、0.1mol·L-1,则c(OH-)甲﹕c(OH-)乙 10(填“>”、“=”或“<”)。
(1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6 kJ热量,写出表示CH4的燃烧热的热化学方程式 。
(2)等物质的量浓度的下列溶液:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH4Fe(SO4)2中 ,c(NH4+)由大到小的顺序为 。
(3)写出符合要求的方程式
①饱和的FeCl3溶液滴入沸水中 (写离子方程式)
②NaHCO3在水溶液中存在的所有电离过程
(4)某温度下的溶液中,c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1。x与y的关系如图所示: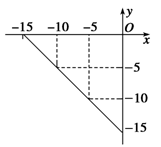
①该温度下,NaCl溶液的pH= 。
②该温度下,pH=8的Ba(OH)2溶液与pH=6的盐酸混合,并保持恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。(忽略溶液混合时体积变化)
在200mL 2mol•L﹣1MgCl2溶液中,溶质的物质的量为 .此溶液中Mg2+的物质的量浓度为 ,Cl﹣的物质的量浓度为 .