(1)下图所示为按树状分类法对一组物质进行的分类。请填写下列标注。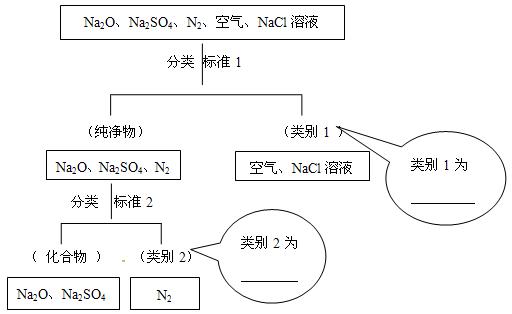
(2)如右图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是________________________。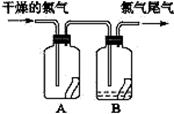
(3) 为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_________________溶液吸收多余的氯气,原理是(用化学方程式表示)__________________________________。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是______________________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______________________(用字母代号填)。
为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_________________溶液吸收多余的氯气,原理是(用化学方程式表示)__________________________________。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是______________________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______________________(用字母代号填)。
| A.O2 | B.Cl2 | C.CO2 | D.HClO |
(15分)
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某
些转化步骤及生成物未列出):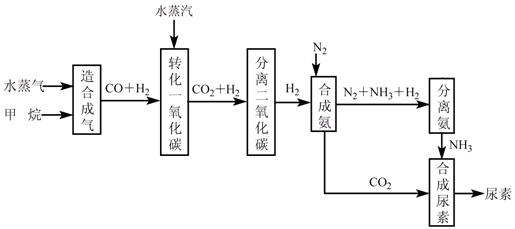
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是: ______。
(2)上述流程中,工业上分离H2、CO2合理的方法是___________。
| A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸 |
| B.混合气加压冷却,使CO2液化 |
| C.混合气用氨水洗涤 |
| D.混合气先通入到石灰浆,然后高温煅烧固体, |
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行___________,目的是________________________________________;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法:。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,请用线段和箭头画出图中的两处合理利用资源情况。
(14分).A、B、C、 D、 E五种溶液分别是NaOH、 NH3·H2O、 CH3COOH 、HCl 、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1xL B溶液、0.001mol·L-1yL D溶液充
分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是溶液,判断理由是。
(2) 用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是(填写序号)
①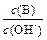 ;②
;②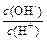 ;
;
③c(H+)和c(OH-)的乘积④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A②开始反应时的速率A>E
③参加反应的锌粉物质的量A="E" ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如下图中的_________曲线(填写序号) 。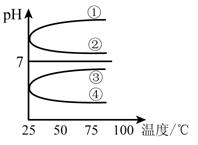
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。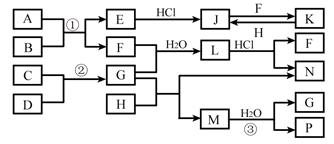
已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为四原子10电子分子,化合物M由两种元素组成,分子内共有58个电子。
(1)写出F的化学式、P的电子式;
(2)在G的水溶液中,阳离子浓度最大的是(用离子符号表示)
(3)写出K与H反应的离子方程式;G与H反应的化学方程式
(4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释。
2004年是俄国化学家马科尼可夫逝世 100周年,马科尼可夫因提出碳碳双键加成规则而著称于世,该规则的应用之一即是确定卤化氢不对称烯烃(主要是指
100周年,马科尼可夫因提出碳碳双键加成规则而著称于世,该规则的应用之一即是确定卤化氢不对称烯烃(主要是指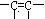 的两个碳原子上连接不同数目氢原子的烯烃)反应时的主要产物。具体表述为:HX与烯烃加成所得主要产物应是卤原子加在含氢较少的双键碳原子上的产物。
的两个碳原子上连接不同数目氢原子的烯烃)反应时的主要产物。具体表述为:HX与烯烃加成所得主要产物应是卤原子加在含氢较少的双键碳原子上的产物。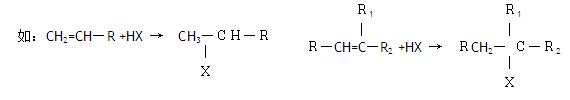 现有如下反应过程:
现有如下反应过程: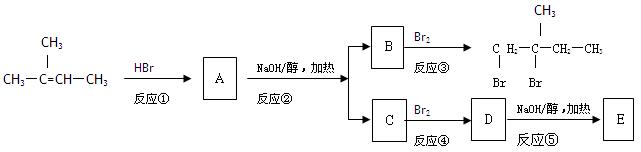 ⑴写出有机物A和C的结构简式:A:;C:。用系统命名法命名有
⑴写出有机物A和C的结构简式:A:;C:。用系统命名法命名有 机物B:
机物B:
⑵上述反应中属于消去反应的是:。
⑶写出反应⑤的化学方程式:。
⑷在E的多种同分异构体中,有一种同分异构体F具有环状结构,且无甲基,在一定条件下能发生加聚反应生成高聚物。写出F发生加聚反应的化学方程式:。
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ,则甲醇燃烧的热化学方程式为。
(2)甲醇燃料电池的结构示意图如下左图。甲醇进入极(填“正”或“负”),正极发生的电极反应为。
(3)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H =-49.0KJ/mol
CH3OH(g)+H2O(g)△H =-49.0KJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如上右图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②该反应的平衡常数表达式为。
③下列措施中能使n(CH3OH)/n(CO2)增大的是。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2