Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成化合物甲,且甲分子中含有10个电子。Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比2∶1反应形成盐丙。
(1)请写出甲的结构式 。(2分)
(2)请写出Q和Y形成的既含极性键又含非极性键的共价化合物的化学式
(3)丙属于 化合物(共价或离子),向少量丙溶液中加入浓NaOH溶液加热,反应的离子方程式是 。
(12分)某烃类化合物A的相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
反应②的化学方程式为;
C的名称为;
E2的结构简式是;
④、⑥的反应类型依次是
 ;。
;。
某温度下,在2 L容器中3种物质间进行反应, X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,依图所示:
⑴①该反应的化学方程式是_____________________。
②在t1 min时,该反应达到了__________状态,下列可作为判断反应已达到该状态的是__________
| A.X、Y、Z的反应速率相等 |
| B.X、Y的反应速率比为2︰3 |
| C.生成3 mol Y的同时生成1 mol Z |
| D.生成1 mol Z的同时生成2 mol X |

 ⑵①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为:__________;在此t1 min时间内,用H2表示反应的平均速率v(H2)= __________。
⑵①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为:__________;在此t1 min时间内,用H2表示反应的平均速率v(H2)= __________。 ②两位同学讨论放热反应和吸热反应。甲说加热后才能发生的化学反应是吸热反应,
②两位同学讨论放热反应和吸热反应。甲说加热后才能发生的化学反应是吸热反应, 乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是______同学。
乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是______同学。
(8分)(1)某晶体的晶胞如图所示,X位于体心,Y位于6面心,Z位于顶点,该晶体中 X、Y、Z的粒子个数比为____ _ __;
(2)Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br] SO4和[Co (SO4) (NH3)5] Br,在第一种配合物的溶液中加BaCl2溶液时,现象是;如果在第二种配合物的溶液中加入BaCl2溶液时,现象是,若在第二种配合物的溶液加入 AgNO3溶液时,现象是。
下图中A~J均代表无机物或其水溶液,其中A是红棕色粉末,B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。已知B可以在高温下与金属活性不如其强的其他金属的氧化物发生置换反应。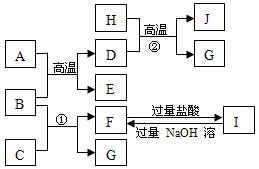
(1)写出下列物质的化学式:
AEI
(2)反应①的离子方程式是E是氧化物(填碱性或酸性或两性)
F与过量盐酸反应的离子方程式是
(3)J与盐酸反应的化学方程式是
反应后的溶液与氯气反应的离子方程式是
有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液。
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
(1)A的化学式是
(2)B的化学式是
(3)原白色粉末中一定含有,可能含有,对可能含有的物质,可通过(填实验名称)进一步检验。