某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/S |
X/mol |
Y/mol |
Z/mol |
 |
| 0 |
1.00 |
1.00 |
0.00 |
|
| 1 |
0.90 |
0.80 |
0.20 |
|
| 3 |
0.75 |
0.50 |
0.50 |
|
| 5 |
0.65 |
0.30 |
0.70 |
|
| 9 |
0.55 |
0.10 |
0.90 |
|
| 10 |
0.55 |
0.10 |
0.90 |
|
| 14 |
0.55 |
0.10 |
0.90 |
(2)体系中发生反应的化学方程式是______________;
(3)列式计算该反应在0-3S时间内产物Z的平均反应速率:_______________;
(4)该反应达到平衡时反应物X的转化率等于___________________________;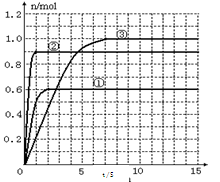
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:①_________②________③________。
已知5种元素的原子序数的大小顺序为C > A > B > D > E, A、C同周期,B、C同主族,A与B形成的离子化合物A2B中,所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子,请回答:
(1)写出元素符号:AC
(2)写出电子式:D元素的单质;B与E形成的化合物;
(3)用电子式表示离子化合物A2B的形成过程
T℃时,将3mol气体A和1mol气体B通入容积为2L且固定不变的密闭容器中,发生如下反应:3A(g)+B(g)  xC (g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
xC (g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
⑴x=;
⑵若向原平衡混合物的容器中再充入amol C ,在T℃达到新的平衡,此时B的物质的量为n(B)=mol;
⑶保持温度和容积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡向右移动的是;
A.均减半 B.均加倍 C.均增加0.4mol D.均减少0.4mol
⑷若上述可逆反应的热化学方程式为:3A(g)+B(g)  xC (g) ΔH=" -QkJ/mol" (Q>0)
xC (g) ΔH=" -QkJ/mol" (Q>0)
①若可逆反应达到平衡后升高体系温度,正反应速率(填“增大”、“减小”或“不变”,平衡将。(填“左移”、“右移”或“不移动”)
②若可逆反应达到平衡后增大压强,则体系温度将;(填“升高”、“降低”或“不变”)
②可逆反应达到平衡后,加入A,则ΔH。(填“变大”、“变小”或“不变”)
(7分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。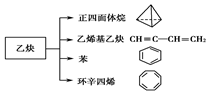
完成下列各题:
(1)正四面体烷的分子式为________,其二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误的是________。
a.能使酸性KMnO4溶液褪色 b.1mol乙烯基乙炔能与3molBr2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例)________、________。
(1) 系统命名法命名: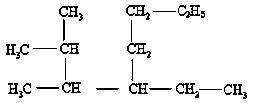
(2)由甲苯为原料,制取烈性炸药(TNT)的化学方程式:
铝铵矾[NH4Al(SO4)2·12H2O]是一种重要的工业原料,将它溶于水配成溶液,然后逐滴滴入NaOH(aq),已知:NH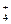 +AlO
+AlO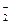 +H2O====Al(OH)3↓+NH3↑,写出先后发生反应的离子方程式:
+H2O====Al(OH)3↓+NH3↑,写出先后发生反应的离子方程式:
(1),
(2),
(3)NH3·H2O NH3↑+H2O,
NH3↑+H2O,
(4)。