(14分)已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
请根据以上情况,回答下列问题:
(1)含有元素A的盐的焰色反应为 。许多金属盐都可以发生焰色反应,其原因是 。
(2)C的氢化物分子的键角是 ,属于 分子。(填“极性”或“非极性”)
(3)BD3的中心原子的杂化类型是
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5的晶体类型为 。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为____ ___。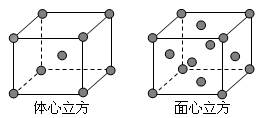
某二元弱酸(简写为H2A)溶液,按下式发生一级或二级电离:
H2A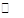 H++HA-,HA-
H++HA-,HA-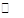 H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A、0.01mol/L的H2A溶液
B、0.01mol/L的NaHA溶液
C、0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合
D、0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合
据此,填写下列空白(填代号):
(1)c(H+)最大的是,最小的是;
(2)c(H2A)最大的是,最小的是;
(3)c(A2-)最大的是,最小的是。
现有如下两个反应:
A、NaOH + HCl =" NaCl" + H2O
B、2FeCl3+Cu =2FeCl2+CuCl2
根据两反应本质, 判断能否设计成原电池:A、_________,B、__________
(选择“能”或“不能”);
(2)如果不能,说明其原因_______________________________________________;
(3)如果可以, 则写出正、负极材料及其电极反应式,电解质溶液:
负极材料________,电极反应式_______________,电解质溶液____________;
正极材料________,电极反应式_______________。
(11分)一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
(1)80~90ml对应反应的离子方程式。
(2)金属铝的质量为_______
(3)盐酸的体积是ml。
(4)a的取值范围是_____。
(5)n(Mg)/n(Al)的最大值是 。
(1)某建筑材料,主要成分为铝硅酸盐,化学式是MgAl2H4Si4O14;化学式改写成氧化物形式为_________。该材料与酸或碱反应时可以看作各氧化物分别与酸、碱反应,则材料该与足量的氢氧化钠反应后过滤,滤渣主要是_______。
(2)除去镁粉中混有的铝粉(用离子方程式表示)。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。原因是(用化学方程式表式)
(4)向100ml水中投入Na和Al共16克,充分反应后剩余金属1g。则放出H2的体积为升(标况下)
(5)标准状况下把11.2L氯气通入500ml0.8mol/LFeBr2溶液中,写出反应完全后的离子方程式
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)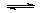 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式:。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式:、。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是。