依据氧化还原反应:2Ag+(aq) + Cu(s) ="=" Cu2+(aq) + 2Ag(s)设计的原电池如图所示。下列说法不正确的是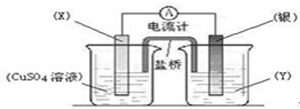
| A.电极X的材料是铜 |
| B.电解质溶液Y是硝酸银溶液; |
| C.银电极为电池的正极,发生的电极反应为:Ag+ + e- ="=" Ag |
| D.盐桥中的阳离子向硫酸铜溶液中运动 |
生活中遇到的某些现实问题,常常涉及到化学知识,下列叙述中不正确的是()
12.油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯,油脂既是重要食物,又是重要的化工原料,油脂的以下性质和用途与其含有不饱和双键(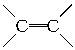 )有关的是()
)有关的是()
| A.适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素 |
| B.利用油脂在碱性条件下的水解,可以生产甘油和肥皂(高级脂肪酸钠) |
| C.植物油通过加氢可以制造植物奶油(人造奶油) |
| D.脂肪是有机体组织里储存能量的重要物质 |
维生素C的结构简式为: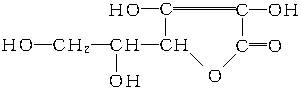
有关它的叙述错误的是()
| A.是一个环状的酯类化合物 | B.易起氧化及加成反应 |
| C.可以溶解于水 | D.在碱性溶液中能稳定地存在 |
下列有机物水解时,键断裂处不正确的是()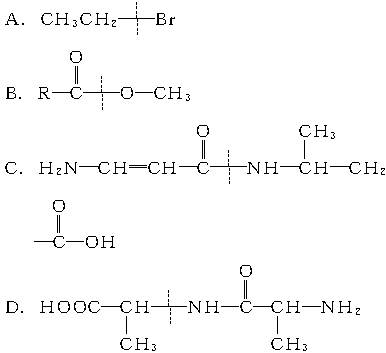
绿色化学是日渐为人们所熟悉的社会概念,绿色食品的基本标准是()
①香甜可口②无污染③表面呈绿色④无化学添加剂⑤有营养价值
| A.①②③⑤ | B.①③④⑤ | C.②④⑤ | D.全部 |
2002年诺贝尔化学奖授予利用“质谱分析法”和“核磁共振技术”等对生物大分子进行研究并作出重大贡献的科学家,下列物质中属于生物大分子的是()
| A.乙醇 | B.葡萄糖 | C.氨基酸 | D.蛋白质 |